
ASSUNTOS DIVERSOS |
PROGRAMA
NACIONAL DE DESESTATIZAÇÃO
ALTERAÇÕES
RESUMO: Foram introduzidas alterações nos procedimentos relativos ao programa em referência, assim como na Lei nº 8.036/90.
LEI Nº 9.635, de 15.05.98
(DOU de 18.05.98)
Altera procedimentos relativos ao Programa Nacional de Desestatização de que trata a Lei nº 9.491, de 9 de setembro de 1997, e dá outras providências.
O PRESIDENTE DA REPÚBLICA
Faço saber que o Congresso Nacional decreta e eu sanciono a seguinte Lei;
Art. 1º - É a União autorizada a transferir:
I - para a Caixa Econômica Federal - CEF, ações ordinárias nominativas, de sua propriedade, representativas do capital social da Companhia Vale do Rio Doce e da Light Serviços de Eletricidade S.A., até o limite de R$ 800.000.000,00 (oitocentos milhões de reais);
II - para o Fundo Nacional de Desestatização - FND, ações representativas do capital social da Petróleo Brasileiro S.A. - PETROBRÁS, depositadas no Fundo de Amortização da Dívida Pública Mobiliária Federal - FAD.
§ 1º - A CEF, em contrapartida à transferência das ações pela União, a que se refere o inciso I deste artigo, deverá assumir dívidas caracterizadas e novadas da União, nos termos da legislação em vigor, relativas ao Fundo de Compensação de Variações Salariais - FCVS, pelo valor nominal equivalente ao valor de venda das referidas ações.
§ 2º - As ações de que trata o inciso I permanecerão depositadas no FND, em nome da CEF.
§ 3º - Não se aplica ao produto da alienação das ações de que trata o inciso I o disposto no inciso III do art. 6º e no art. 13 da Lei nº 9.491, de 9 de setembro de 1997, e no art. 30 da Lei nº 8.177, de 1º de março de 1991, com a redação ora vigente.
§ 4º - A CEF somente poderá vender as ações a que se refere o inciso I deste artigo para Fundos Mútuos de Privatização de que trata o inciso XII do art. 20 da Lei nº 8.036, de 11 de maio de 1990, com a redação dada pela Lei nº 9.491, de 1997.
§ 5º - A transferência das ações a que se refere o inciso I é condicionada à aprovação, por parte do Conselho Nacional de Desestatização - CND, do limite para participação dos Fundos Mútuos de Privatização - FMP-FGTS, de que trata o inciso XII do art. 20 da Lei nº 8.036, de 1990, nas respectivas ofertas públicas e leilões de privatização, e dar-se-á no momento em que for estabelecido o preço de venda dessas ações.
Art. 2º - O art. 20 da Lei nº 8.036, de 1990, com as modificações introduzidas pelo art. 31 da Lei nº 9.491, de 1997, passa a vigorar com as seguintes alterações:
"Art. 20 - ...
...
§ 6º - Os recursos aplicados em cotas de fundos Mútuos de Privatização, referidos no inciso XII, serão destinados, nas condições aprovadas pelo CND, a aquisições de valores mobiliários, no âmbito do Programa Nacional de Desestatização, de que trata a Lei nº 9.491, de 1997, e de programas estaduais de desestatização, desde que, em ambos os casos, tais destinações sejam aprovadas pelo CND.
§ 7º - Ressalvadas as alienações decorrentes das hipóteses de que trata o § 8º, os valores mobiliários a que se refere o parágrafo anterior só poderão ser integralmente vendidos, pelos respectivos Fundos, seis meses após a sua aquisição, podendo ser alienada em prazo inferior parcela equivalente a 10% (dez por cento) do valor adquirido, autorizada a livre aplicação do produto dessa alienação, nos termos da Lei nº 6.385, de 7 de dezembro de 1976.
...
§ 16 - Os clubes de investimento a que se refere o § 12 poderão resgatar, durante os seis primeiros meses da sua constituição, parcela equivalente a 5% (cinco por cento) das cotas adquiridas, para atendimento de seus desembolsos, autorizada a livre aplicação do produto dessa venda, nos termos da Lei nº 6.385, de 7 de dezembro de 1976."
Art. 3º - O Poder Executivo regulamentará o disposto nesta Lei.
Art. 4º - São convalidados os atos praticados com base na Medida Provisória nº 1.613-6, de 2 de abril de 1998.
Art. 5º - Esta Lei entra em vigor na data de sua publicação.
Brasília, 15 de maio de 1998; 177º da Independência e 110º da República.
Fernando Henrique Cardoso
Pedro Malan
Edward Amadeo
Paulo Paiva
PLANO REAL
MEDIDAS COMPLEMENTARES
RESUMO: Deixamos de transcrever a íntegra da presente Medida Provisória, tendo em vista que o seu texto não apresenta substanciais modificações em relação ao da MP nº 1.540-27/97 (Bol. INFORMARE nº 34/97).
MEDIDA PROVISÓRIA Nº 1.620-37,
de 12.05.98
(DOU de 13.05.98)
Dispõe sobre medidas complementares ao Plano Real e dá outras providências.
AFRMM/FMM
ALTERAÇÕES NA LEGISLAÇÃO
RESUMO: Estamos publicando a íntegra da presente Medida Provisória, tendo em vista que o seu texto apresenta modificações em relação ao da MP nº 1.551-25/97 (Bol. INFORMARE nº 34/97).
MEDIDA PROVISÓRIA Nº 1.627-35,
de 12.05.98
(DOU de 13.05.98)
Altera a legislação referente ao Adicional ao Frete para a Renovação da Marinha Mercante - AFRMM e ao Fundo da Marinha Mercante - FMM, e dá outras providências.
O PRESIDENTE DA REPÚBLICA, no uso da atribuição que lhe confere o art. 62 da Constituição, adota a seguinte Medida Provisória, com força de lei:
Art. 1º - Os arts. 2º, 3º, 5º, 9º, 10, 16, 22, 23 e parágrafo único do art. 29 do Decreto-lei nº 2.404, de 23 de dezembro de 1987, alterado pelo Decreto-lei nº 2.414, de 12 de fevereiro de 1988, pela Lei nº 7.742, de 20 de março de 1989, e pela Lei nº 8.032, de 12 de abril de 1990, passam a vigorar com as seguintes alterações:
"Art. 2º - O AFRMM é um adicional de frete cobrado pelas empresas brasileiras e estrangeiras de navegação que operem em porto brasileiro, de acordo com o conhecimento de embarque e o manifesto de carga, pelo transporte de carga de qualquer natureza, exceto na navegação fluvial e lacustre, na qual incidirá apenas nas cargas de granéis líquidos, e constitui fonte básica do Fundo da Marinha Mercante.
..." (NR)
"Art. 3º - ...
I - 25%, na navegação de longo curso;
II - 10%, na navegação de cabotagem;
III - 20%, na navegação fluvial e lacustre, observado o disposto no art. 2º.
..." (NR)
"Art. 5º - ......
III - ...
a) por belonaves, nacionais ou estrangeiras, quando não empregadas em viagem de caráter comercial;
b) nas atividades de explotação e de apoio à explotação de hidrocarbonetos e outros minerais sob a água, desde que na zona econômica exclusiva brasileira;
IV - ...
...
c) exportados temporariamente para outro país e condicionados à reimportação em prazo determinado;
d) armamentos, produtos, materiais e equipamentos importados pelos Ministérios militares, ficando condicionados, em cada caso, à declaração do titular da Pasta respectiva de que a importação destina-se a fins exclusivamente militares e é de interesse para a segurança nacional;
e) destinados à pesquisa científica e tecnológica, conforme disposto em lei, cabendo ao CNPq encaminhar ao órgão competente do Ministério dos Transportes, para fins de controle, relação de importadores e o valor global, por entidade, das importações autorizadas;
V - ...
...
b) importadas em decorrência de atos firmados entre pessoas jurídicas, de direito público externo, celebrados e aprovados pelo Presidente da República e ratificados pelo Congresso Nacional, que contenham cláusula expressa de isenção de pagamento do AFRMM, sendo o pedido de reconhecimento de isenção formulado ao órgão competente do Ministério dos Transportes;
c) que sejam objeto das operações previstas nos regimes estabelecidos no art. 78 do Decreto-lei nº 37, de 18 de novembro de 1966, ficando a isenção condicionada à exportação para o exterior das mercadorias submetidas aos referidos regimes aduaneiros especiais, excetuando-se do atendimento desta condição de efetiva exportação as operações realizadas a partir de 5 de outubro de 1990, nos termos do § 2º do art. 1º da Lei nº 8.402, de 8 de janeiro de 1992;
d) importadas pela União através de órgão federal da Administração direta e entidades autárquicas e fundacionais supervisionadas;
e) que retornem ao País nas seguintes condições:
1. enviadas em consignação e não vendidas nos prazos autorizados;
2. por defeito técnico que exija sua devolução, para reparo ou substituição;
3. por motivo de modificações na sistemática do país importador;
4. por motivo de guerra ou calamidade pública;
5. por quaisquer outros fatores comprovadamente alheios à vontade do exportador brasileiro;
f) que sejam destinadas ao consumo ou industrialização na Amazônia Ocidental, excluídas armas, munições, fumo, bebidas alcoólicas, perfumes, automóveis de passageiros e cargas ou granéis líquidos;
g) que sejam destinadas ao consumo ou à industrialização na Zona Franca de Manaus, excluídas armas, munições, fumo, bebidas alcoólicas, perfumes e automóveis de passageiros.
h) importadas por permissionários autorizados pelo Ministério da Fazenda, para venda, exclusivamente em lojas francas, a passageiros de viagens internacionais;
i) submetidas a transbordo ou baldeação em portos brasileiros, quando destinadas à exportação e provenientes de outros portos brasileiros;
j) que estejam expressamente definidas em lei como isentas do AFRMM.
§ 1º - Sobre as mercadorias destinadas a porto brasileiro, que efetuarem baldeação ou transbordo em um ou mais portos nacionais, não incidirá novo AFRMM, referente ao transporte entre os citados portos, se este já tiver sido calculado sobre o frete desde a sua origem até seu destino final.
§ 2º - Ficam suspensas do pagamento do AFRMM, passando o novo prazo de recolhimento, correspondente à totalidade ou à parte de carga, a partir da data de sua nacionalização, nos seguintes casos, desde que não estejam alcançados pelas isenções previstas nesta Lei:
a) as mercadorias submetidas aos seguintes regimes aduaneiros especiais:
1. trânsito aduaneiro;
2. entreposto aduaneiro;
3. entreposto industrial;
b) as mercadorias submetidas aos seguintes regimes aduaneiros atípicos:
1. depósito especial alfandegado;
2. depósito afiançado;
3. depósito franco." (NR)
"Art. 9º - As parcelas recolhidas à conta a que se refere o item III do art. 8º serão aplicadas pelos agentes financeiros em operações de mercado aberto, com títulos públicos federais, e o valor total será rateado entre as empresas brasileiras de navegação autorizadas a operar, proporcionalmente ao total de fretes por elas gerado nos tráfegos de importação e exportação do comércio exterior brasileiro, obtido quando operando embarcações próprias ou afretadas de registro brasileiro, bem como embarcações afretadas de registro estrangeiro no regime de que trata o § 1º e 3º do art. 8º, incluídas as embarcações fluviais que participarem do transporte de bens para exportação.
..." (NR)
"Art. 10 - ...
I - ...
...
e) para pagamento de prestações de principal e encargos de empréstimos concedidos pelo Agente Financeiro, com recursos de outras fontes, que tenham por objeto as modalidades de apoio previstas nos itens 1, 2 e 3 da alínea "a" do inciso I do art. 16;
f) para pagamento de prestações de principal e encargos de empréstimos obtidos junto à FINAME e ao Programa Amazônia Integrada - PAI, por intermédio de qualquer estabelecimento bancário autorizado a operar com estes recursos e que tenham por objeto as modalidades de apoio previstas nos itens 1, 2 e 3 da alínea "a" do inciso I do art. 16, desde que a interessada esteja adimplente com as obrigações previstas nas alíneas "d" e "e" deste inciso;
II - compulsoriamente, na amortização de dívidas vencidas decorrentes dos empréstimos referidos nas alíneas "d" e "e" do inciso anterior." (NR)
"Art. 16 - ...
I - em apoio financeiro reembolsável, mediante concessão de empréstimo, ou para honrar garantias concedidas:
a) a empresas brasileiras de navegação, até 85% do valor do projeto aprovado:
1. para construção de embarcações em estaleiros brasileiros;
2. para o reparo de embarcações próprias, quando realizado por empresas brasileiras;
3. para a manutenção ou modernização de embarcações próprias, inclusive para a aquisição e instalação de equipamentos necessários, quando realizadas por empresas brasileiras;
b) a empresas brasileiras de navegação, estaleiros brasileiros e outras empresas ou entidades brasileiras, para projetos de pesquisa e desenvolvimento científico ou tecnológico e formação de recursos humanos voltados para os setores da marinha mercante, construção ou reparo naval;
c) a estaleiros brasileiros, para financiamento à produção de embarcações destinadas à exportação, até oitenta por cento do seu preço de venda;
d) à Marinha do Brasil, para a construção de embarcações auxiliares, hidrográficas e oceanográficas, em estaleiros brasileiros;
e) a empresas brasileiras, para a construção de diques flutuantes, dragas e cábreas, no interesse da marinha mercante brasileira, em estaleiros brasileiros;
f) para outras aplicações em investimentos, no interesse da marinha mercante brasileira;
II - no pagamento ao Agente Financeiro:
a) de valor correspondente à diferença apurada entre o custo de captação para o Agente Financeiro e o custo dos financiamentos contratados com o beneficiário;
b) das comissões devidas pela concessão de financiamentos realizados com recursos do FMM e de outras fontes, a título de administração ou risco das operações;
c) da comissão devida pela administração de operações aprovadas pelo Ministro de Estado dos Transportes com base no § 5º do art. 12 do Decreto-lei nº 1.801, de 18 de agosto de 1980, ou contratadas até 31 de dezembro de 1987;
III - na diferença entre o custo interno efetivo de construção de embarcações e o valor das operações contratadas com recursos do FMM e de outras fontes, limitada a dez por cento do valor do contrato de construção de embarcação destinada ao mercado interno;
IV - na constituição de um crédito-reserva, até o limite de vinte por cento do valor do contrato de financiamento, concedido com recursos do FMM e de outras fontes, à produção de embarcação destinada à exportação, visando assegurar o término da obra, no caso de descumprimento da correspondente obrigação de fazer, por parte do estaleiro.
§ 1º - As comissões de que tratam as alíneas "b" e "c" do inciso II deste artigo serão fixadas pelo Conselho Monetário Nacional e revisadas a cada biênio, e serão cobertas, exclusivamente, com recursos do FMM, deduzida a parcela destinada ao serviço da dívida assumida pela União, na qualidade de sucessora da extinta Superintendência Nacional da Marinha Mercante - SUNAMAM.
§ 2º - As operações financeiras reembolsáveis, resultantes das aplicações a que se referem os incisos III e IV, deste artigo, terão seus prazos e encargos regulados na forma do disposto no art. 26." (NR)
"Art. 22 - Os financiamentos concedidos com recursos do FMM, destinados à construção, reparo ou melhoria de embarcações, poderão ter como garantia a alienação fiduciária ou hipoteca da embarcação financiada, ou outras modalidades de garantia, a critério do Agente Financeiro.
Parágrafo único - A alienação fiduciária só terá validade e eficácia após sua inscrição no Registro de Propriedade Marítima, junto ao Tribunal Marítimo, aplicando-se-lhe, no que couber, o disposto nos arts. 148 a 152 da Lei nº 7.565, de 19 de dezembro de 1986." (NR)
"Art. 23 - A alienação das embarcações que, para construção, reparo ou melhoria, tenham sido objeto de financiamento com recursos do FMM, dependerá de prévia autorização do Ministério dos Transportes, quando o risco da operação for do FMM." (NR)
"Art. 29 - ...
Parágrafo único - O orçamento anual do FMM poderá conter dotações para despesas que se refiram ao pagamento do serviço da dívida, de estudos e projetos do interesse da marinha mercante e dos serviços administrativos da arrecadação." (NR)
Art. 2º - Fica o FMM autorizado a efetuar, até 30 de junho de 1996, cessão de créditos ao agente financeiro, relativos às operações de financiamento realizadas com recursos do FMM.
§ 1º - A autorização concedida nos termos do caput deste artigo fica condicionada à audiência prévia da Secretaria do Tesouro Nacional.
§ 2º - Nos casos em que exercida a faculdade de que trata o caput deste artigo, o Agente Financeiro transferirá ao FMM direitos que detenha contra o Tesouro Nacional.
§ 3º - Caso o montante dos direitos do agente financeiro contra o Tesouro Nacional seja inferior ao dos valores cedidos, o saldo será liquidado na forma referida no inciso II do art. 16 do Decreto-Lei nº 2.404, de 1987, com a redação dada pelo art. 1º desta Medida Provisória.
§ 4º - O FMM utilizará os direitos recebidos do agente para quitação de suas obrigações vencidas junto à União, na qualidade de sucessora da extinta SUNAMAM, em relação ao sistema bancário e à indústria naval.
§ 5º - A União responderá pela inexistência parcial ou total do crédito cedido nos termos do caput deste artigo, por força de decisão judicial transitada em julgado, ficando para tanto autorizada a emissão de títulos do Tesouro Nacional, com registro na Central de Custódia e de Liquidação Financeira de Títulos - CETIP.
§ 6º - Os valores recebidos pelo FMM, em pagamento de qualquer obrigação referente aos contratos cedidos, em conformidade com o disposto no caput deste artigo, entre a data-base de referência estabelecida no Contrato de Cessão e a data de sua celebração, serão devidos pelo FMM ao agente financeiro e remunerados, a partir de seu recebimento até a data de sua liquidação, pelo mesmo critério de remuneração aplicado às disponibilidades do FMM.
Art. 3º - Não se aplicam ao disposto no inciso V, alínea "c", do art. 5º do Decreto-lei nº 2.404, de 1987, as operações realizadas nos termos do § 2º do art. 1º da Lei nº 8.402, de 1992.
Art. 4º - Ficam convalidados os atos praticados com base na Medida Provisória nº 1.627-34, de 04 de abril de 1998.
Art. 5º - Esta Medida Provisória entra em vigor na data de sua publicação.
Art. 6º - Revogam-se o parágrafo único do art. 15 e os arts. 17, 18, 19 e 20 do Decreto-Lei nº 2.404, de 23 de dezembro de 1987, o art. 11 da Lei nº 7.742, de 20 de março de 1989, e o caput do art. 9º da Lei nº 8.032, de 12 de abril de 1990.
Brasília, 12 de maio de 1998; 177º da Independência e 110º da República.
Fernando Henrique Cardoso
Pedro Malan
Eliseu Padilha
Paulo Paiva
MICROEMPRESAS E
EMPRESAS DE PEQUENO PORTE
ARQUIVAMENTO DE ATOS NAS JUNTAS COMERCIAIS E PROTESTO DE TÍTULO DE DÍVIDAS
RESUMO: Deixamos de publicar a íntegra da presente Medida Provisória, tendo em vista que o seu texto não apresenta modificações em relação ao da MP nº 1.638-2/98 (Bol. INFORMARE nº 14/98).
MEDIDA PROVISÓRIA Nº 1.638-4,
de 12.05.98
(DOU de 13.05.98)
Dispõe sobre a simplificação do arquivamento de atos nas Juntas Comerciais e do protesto de título de dívidas de microempresas e de empresas de pequeno porte, e dá outras providências.
CVM
ADEQUAÇÃO DOS SISTEMAS ELETRÔNICOS VISANDO AO CORRETO PROCESSAMENTO DAS DATAS
POSTERIORES AO ANO DE 1999
RESUMO: A Instrução a seguir estabelece procedimentos a serem adotados para a adequação dos sistemas eletrônicos visando ao correto processamento das datas posteriores ao ano de 1999.
INSTRUÇÃO CVM Nº 276, de
08.05.98
(DOU de 15.05.98)
Dispõe sobre os procedimentos a serem adotados para a adequação dos sistemas eletrônicos visando ao correto processamento das datas posteriores ao ano de 1999.
O PRESIDENTE DA COMISSÃO DE VALORES MOBILIÁRIOS - CVM torna público que o Colegiado, em reunião realizada nesta data, tendo em vista o disposto no art. 8º, incisos I e III, da Lei nº 6.385, de 7 de dezembro de 1976, resolveu baixar a seguinte Instrução:
Art. 1º - As bolsas de valores e de futuros, as caixas de liquidação e compensação, os prestadores de serviços de emissão de certificados, escrituração e custódia de valores mobiliários, os administradores de fundos de investimento sob jurisdição da CVM, as companhias abertas e as companhias incentivadas devem adequar os seus sistemas eletrônicos automatizados até 31 de dezembro de 1998, visando ao correto processamento das datas posteriores ao ano de 1999.
Art. 2º - As instituições e sociedades referidas no artigo anterior devem divulgar informações sobre o processo de transformação ou de adaptação dos seus sistemas eletrônicos de dados.
§ 1º - As companhias abertas e as incentivadas devem divulgar as informações em nota explicativa anexa às Demonstrações Financeiras e às Informações Trimestrais - ITRs, se for o caso, que deverão conter, no mínimo:
I - a natureza e os montantes dos gastos e investimentos efetuados no período e os que deverão ser ainda efetuados;
II - as medidas adotadas para ajustamento dos seus sistemas e o andamento dos trabalhos correspondentes;
III - os possíveis efeitos nos negócios e os riscos envolvidos.
§ 2º - No caso dos administradores de fundos de investimento cuja constituição e funcionamento sejam autorizados pela CVM, as Demonstrações Financeiras ou relatório dos administradores devem conter nota explicativa sobre os procedimentos realizados, em curso, ou sobre a não-adoção de qualquer providência, relativos à adequação a que se refere o art. 1º.
Art. 3º - Os agentes de que trata esta Instrução devem estimar os gastos e investimentos necessários para adaptação ou transformação de seus sistemas eletrônicos e considerar, em face do disposto no art. 184, inciso I, da Lei nº 6.404, de 15 de dezembro de 1976, a necessidade de constituição de provisão para atender aos gastos e investimentos acima referidos.
Art. 4º - Cabe ao auditor independente verificar o correto cumprimento do disposto nos arts. 2º e 3º desta Instrução, fazendo constar no seu parecer a omissão da informação ou a falta do necessário provisionamento.
Art. 5º - Cabe ainda ao auditor independente emitir relatórios de auditoria abordando, dentre outros, os seguintes aspectos:
I - grau de comprometimento e envolvimento da administração no processo;
II - grau de formalização;
III - existência e adequação do cronograma previsto;
IV - existência de inventário de informações relativas a "hardware" e "software";
V - existência de avaliação de impacto, análise de riscos e priorização dos sistemas;
VI - grau de comprometimento e envolvimento de terceiros;
VII - existência de plano de testes e cronograma de implantação;
VIII - existência de plano de procedimentos de contingência.
Parágrafo único - O relatório de que trata o art. 8º da Instrução CVM nº 89, de 8 de novembro de 1988, deverá contemplar os procedimentos realizados, ou em curso, sobre os itens referidos neste artigo, bem como a não-adoção de qualquer providência relativa à adequação de que trata esta Instrução.
Art. 6º - É de responsabilidade do superintendente geral das bolsas de valores e futuros o cumprimento das obrigações estabelecidas por esta Instrução no âmbito daquelas instituições.
Art. 7º - As caixas de liquidação e compensação, os prestadores de serviços de emissão de certificados, escrituração e custódia de valores mobiliários, administradores de fundos fiscalizados pela CVM e as companhias abertas e incentivadas devem designar diretor estatutário ou sócio gerente responsável pelo cumprimento do disposto nesta Instrução, no âmbito dessas entidades, informando à CVM o respectivo nome até 30 de junho de 1998.
Art. 8º - O descumprimento da obrigação no prazo estipulado no art. 1º desta Instrução ensejará a aplicação de multa cominatória diária que incidirá a partir do primeiro dia útil subseqüente ao término do prazo para cumprimento da obrigação regulamentar, independentemente de intimação, nos seguintes valores:
I - R$ 500,00 (quinhentos reais) para as bolsas de valores e de futuros, as caixas de liquidação e compensação, os prestadores de serviços de emissão de certificados, escrituração, custódia de valores mobiliários e administradores de fundos fiscalizados pela CVM e as companhias abertas;
II - R$ 200,00 (duzentos reais) para as companhias incentivadas.
Art. 9º - Esta Instrução entra em vigor na data de sua publicação no Diário Oficial da União.
Francisco da Costa e Silva
INTERNET
REGISTRO DE NOME DE DOMÍNIO - NORMAS
RESUMO: A Resolução a seguir estabelece normas para o registro de nomes de domínio na Internet.
RESOLUÇÃO CG Nº 1, de 15.04.98
(DOU de 14 e 15.05.98)
O COORDENADOR DO COMITÊ GESTOR INTERNET DO BRASIL, no uso de suas atribuições, torna público que o referido Comitê, em reunião realizada no dia 15 de abril 1998, emitiu a seguinte Resolução:
"RESOLUÇÃO Nº 001/98
O COMITÊ GESTOR INTERNET DO BRASIL - CG, no uso das atribuições que lhe confere a Portaria Interministerial MC/MCT nº 147, de 31 de maio de 1995,
Considerando que, para conectividade à INTERNET, com o objetivo de disponibilização de informações e serviços, é necessário o registro de nomes de domínio e a atribuição de endereços IP (Internet Protocol), bem como a manutenção de suas respectivas bases de dados na rede eletrônica;
Considerando que dentre as atribuições institucionais do Comitê insere-se a de "coordenar a atribuição de endereços IP (INTERNET PROTOCOL) e o registro de nomes de domínio";
Considerando, finalmente, ser necessário que se consolidem as decisões do Comitê Gestor acerca destas atividades,
RESOLVE:
Art. 1º - O Registro de Nome de Domínio adotará como critério o princípio de que o direito ao nome do domínio será conferido ao primeiro requerente que satisfizer, quando do requerimento, as exigências para o registro do nome, conforme as condições descritas nesta Resolução e seus Anexos.
§ 1º - Caso o requerente não satisfaça qualquer das condições para o registro do nome, na ocasião do requerimento, este será considerado sem efeito, permanecendo o nome liberado para registro por quem satisfaça as condições e o requeira.
§ 2º - Constituem obrigações do requerente a escolha adequada e o uso regular do nome de domínio requerido, a observância das regras previstas nesta Resolução e seus Anexos, bem como das constantes do documento de Solicitação de Registro de Nome de Domínio.
§ 3º - A escolha do nome de domínio requerido e a sua adequada utilização são da inteira responsabilidade do requerente, o qual, ao formular o requerimento do registro exime o CG e o executor do registro, se outro, de toda e qualquer responsabilidade por quaisquer danos decorrentes de seu uso indevido, passando a responder por quaisquer ações judiciais ou extra-judiciais que resultem de violação de direitos ou de prejuízos causados a outrem.
§ 4º - O registro do nome de domínio poderá ser cancelado em qualquer das hipóteses previstas no art. 7º.
Art. 2º - É permitido o registro de nome de domínio tão-somente para entidades que funcionem legalmente no País, profissionais liberais e pessoas físicas, conforme disposto no Anexo II desta Resolução.
Art. 3º - As categorias sob as quais serão registrados os nomes de domínio são as descritas no Anexo II, sob o espaço br reservado ao Brasil pelo InterNic/IANA.
Art. 4º - É da inteira responsabilidade do titular do nome de domínio a eventual criação e o gerenciamento de novas divisões e subdomínios sob o nome de domínio por ele registrado.
Art. 5º - Pelo registro de nome de domínio e por sua manutenção anual na rede eletrônica serão cobradas retribuições.
§ 1º - A retribuição por cada registro de nome de domínio será cobrada uma única vez.
§ 2º - A retribuição pela manutenção será cobrada por ano-calendário, no seu primeiro trimestre. No ano em que ocorrer o registro do nome de domínio, o valor da retribuição pela manutenção será cobrado proporcionalmente aos meses faltantes para o seu encerramento, juntamente com a retribuição devida pelo registro.
Art. 6º - A retribuição a que se refere o artigo 5º será cobrada pela entidade responsável pela realização do registro de nomes de domínio e sua manutenção, devendo ser compatível com os valores praticados internacionalmente.
Art. 7º - Extingue-se o direito de uso de um nome de domínio registrado na Internet sob o domínio .br, ensejando o seu cancelamento, nos seguintes casos:
I - pela renúncia expressa do respectivo titular, por meio de documentação hábil;
II - pelo não pagamento nos prazos estipulados da retribuição pelo registro e/ou sua manutenção;
III - pelo não uso regular do nome de domínio, por um período contínuo de 180 (cento e oitenta) dias;
IV - pela inobservância das regras estabelecidas nesta Resolução e seus Anexos.
V - por ordem judicial;
Parágrafo único - Nos casos previstos nos incisos II e IV, o titular será notificado para satisfazer à exigência no prazo de 30 (trinta) dias, decorridos os quais, sem atendimento, será cancelado o registro.
Art. 8º - Constitui obrigação do requerente e do titular do nome de domínio manter atualizados seus dados junto à entidade incumbida do registro.
Parágrafo único - Se o titular do nome de domínio mudar de endereço sem atualizá-lo junto à entidade incumbida do registro, reputar-se-ão válidas as notificações comprovadamente enviadas para o endereço constante naquela entidade.
Art. 9º - Em qualquer hipótese de cancelamento do registro do nome de domínio não assistirá ao titular direito a qualquer ressarcimento ou indenização.
Art. 10 - Esta Resolução entra em vigor na data de sua publicação no Diário Oficial da União, devendo ser divulgada no endereço eletrônico do servidor web do CG na Internet: http://www.cg.org.br."
Roberto Pinto Martins
ANEXO
DO REGISTRO DE DOMÍNIO
Art. 1º - São condições imprescindíveis para que o processo de registro de um nome de domínio possa prosseguir até sua efetivação, em adição às mencionadas na Resolução CG nº 001/98, as seguintes:
I - uma instituição poderá registrar no máximo 10 (dez) nomes de domínio utilizando um único CGC. Para esse efeito, será levada em conta a possível existência de filiais, o que eqüivale a dizer que a instituição terá direito, além dos dez registros correspondentes à matriz, a tantos grupos de até dez registros quantas sejam as filiais cujo CGC se apresente.
II - todos os nomes registrados sob um CGC deverão estar sob o mesmo Domínio de Primeiro Nível (DPN), salvo as seguintes exceções:
a) - temporariamente um CGC pode abrigar o mesmo conjunto de nomes em dois DPNs diferentes, quando se tratar da transição de um DPN para outro. Por exemplo, na transição do .com para o .ind, o requerente poderá manter funcionando o seu conjunto de domínios simultaneamente sob o .com e sob o .ind enquanto se processa a transição. O registro deverá prover um período de coexistência de 180 (cento e oitenta) dias até que a transição se efetue. Findo este período, volta a valer a unicidade de DPN por CGC.
b) - Para estimular os Provedores de Serviços Internet a se cadastrarem sob o domínio .psi sem perda de funcionalidade simultânea sob o DPN .com, a coexistência entre o DPN .com e o DPN .psi será inicialmente por prazo indeterminado. Esta exceção aplica-se exclusivamente à coexistência dos DPNs .com e .psi.
Art. 2º - O nome escolhido para registro deve ter:
I - comprimento mínimo de 2 caracteres e máximo de 26 caracteres;
II - uma combinação de letras e números, não podendo ser exclusivamente numérico. Como letras entende-se exclusivamente o conjunto de caracteres de a a z. O único caracter especial permitido além de letras e números é o hífen (-);
III - o nome escolhido pelo requerente para registro, sob determinado DPN, deve estar disponível para registro neste DPN, o que subentende que:
a) - não tenha sido registrado ainda por nenhum requerente anterior neste DPN. Para esse critério é importante notar que o hífen (-) não é considerado parte distintiva do nome, ou seja, se "meu domínio" está registrado, não é possível registrar "meu-domínio" ou outras variações em que a única diferença seja a presença do hífen(-);
b) não pode tipificar nome não registrável. Entende-se por nome não registrável, entre outros, palavras de baixo calão, os que pertençam a nomes reservados mantidos pelo CG e pela FAPESP com essa condição, por representarem conceitos predefinidos na rede Internet, como é o caso do nome "internet" em si, os que possam induzir terceiros a erro, como no caso de nomes que representam marcas de alto renome ou notoriamente conhecidas, quando não requeridos pelo respectivo titular, siglas de Estados, de Ministérios, etc.
Art. 3º - No ato do preenchimento do pedido de registro devem ser explicitados no mínimo dois e no máximo cinco servidores de Domain Name System (DNS) que respondam pelo nome de domínio solicitado. Caso pelo menos dois desses DNS não estejam ativos na rede no momento da verificação que precede o registro, o processamento do pedido será cancelado instantaneamente.
Parágrafo único - No preenchimento do requerimento por parte do interessado deverá ser observado que:
I - o Contato Administrativo seja, de fato e de direito, alguém ligado à instituição requerente do registro;
II - o Contato Técnico pode ou não pertencer à instituição requerente. Em muitos casos, o Contato Técnico pertencerá ao provedor do requerente;
III - a adequada identificação do Contato Contábil e o correto fornecimento dos endereços físico e eletrônico do requerente, bem como a atualização decorrente de sua eventual mudança são imprescindíveis para o recebimento de notificações e de cobranças, e, conseqüentemente, da manutenção do registro em atividade;
IV - os dados expressos no registro devem ser mantidos atualizados. O operador do registro brasileiro fará uso intensivo de correio eletrônico (e-mail) em suas comunicações com os titulares de domínios e, dessa forma, a manutenção do bom funcionamento do serviço de correio eletrônico é crítico e imprescindível para a disseminação de informações e realização de notificações sobre o registro e sua manutenção.
INTERNET
ATIVIDADES DE REGISTRO DE NOMES DE DOMÍNIO, DISTRIBUIÇÃO DE ENDEREÇOS IPs E SUA
MANUTENÇÃO NA REDE
RESUMO: A Resolução a seguir delega competência à Fapesp para realizar as atividades de registro de nomes de domínio, distribuição de endereços IPs e sua manutenção na rede eletrônica Internet.
RESOLUÇÃO Nº CG 2, de 15.04.98
(DOU de 14 e 15.05.98)
O COORDENADOR DO COMITÊ GESTOR INTERNET DO BRASIL, no uso de suas atribuições, torna público que o referido Comitê, em reunião realizada no dia 15 de abril de 1998, emitiu a seguinte Resolução:
"RESOLUÇÃO Nº 002/98
O COMITÊ GESTOR INTERNET DO BRASIL - CG, no uso das atribuições que lhe confere a Portaria Interministerial MC/MCT nº 147, de 31 de maio de 1995, tendo em vista o disposto na Resolução CG nº 001, de 15 de abril de 1998, e
Considerando que, para conectividade à INTERNET, com o objetivo de disponibilização de informações e serviços, é necessário o registro de nomes de domínio e a atribuição de endereços IP (Internet Protocol), bem como a manutenção de suas respectivas bases de dados na rede eletrônica;
Considerando que dentre as atribuições institucionais do CG insere-se a de 'coordenar a atribuição de endereços IP (INTERNET PROTOCOL) e o registro de nomes de domínio';
Considerando que a execução das atividades relativas ao registro de nomes de domínios e atribuição de endereços IPs vem sendo realizada pela Fundação de Amparo à Pesquisa do Estado de São Paulo - FAPESP, no âmbito do Projeto Rede Nacional de Pesquisas - RNP, que têm suportado os respectivos custos;
Considerando que o CG aprovou, por unanimidade, que a FAPESP continue a realizar a execução destas atividades para todo o território nacional;
Considerando que o estágio já alcançado pelos serviços INTERNET no País não mais justifica a assunção pelo Poder Público dos custos incorridos com os registros de nomes de domínio, distribuição de endereços IPs e respectiva manutenção em atividade;
Considerando que devem os interessados em tais serviços arcar com os ônus decorrentes de sua utilização; e,
Considerando, finalmente, as atividades já efetivamente realizadas relativamente ao registro de nomes de domínio, distribuição de endereços IPs e sua manutenção em atividade, os custos decorrentes e os preços praticados internacionalmente,
RESOLVE:
Art. 1º - Delegar competência à FAPESP para realizar as atividades de registro de nomes de domínio, distribuição de endereços IPs e sua manutenção na rede eletrônica INTERNET.
§ 1º - Ficam referendados os atos já praticados pela FAPESP relativos às atividades de que trata o caput deste artigo.
§ 2º - As condições de registro e cancelamento de Nomes de Domínio a serem seguidas pela FAPESP observarão as regras estabelecidas na Resolução CG nº 001, de 15 de abril de 1998.
Art. 2º - Pela realização das atividades a que se refere o art. 1º a FAPESP cobrará valores compatíveis com os vigentes internacionalmente, previamente aprovados pelo CG.
Parágrafo único - A cobrança prevista neste artigo observará o disposto no art. 5º da Resolução CG nº 001, de 15 de abril de 1998, e abrangerá inclusive os registros existentes em 1997 que foram mantidos e a anuidade relativa àquele exercício, cujo valor deverá ser proporcional aos meses de manutenção na rede.
Art. 3º - O produto da arrecadação decorrente das atividades de que trata esta Resolução deverá ser utilizado pela FAPESP para ressarcir-se dos custos incorridos com as mesmas e para promover atividades ligadas ao desenvolvimento da Internet no Brasil.
Parágrafo único - Deverão ser submetidos à aprovação prévia do CG os valores e o cronograma de dispêndios a serem realizados, bem como a correspondente prestação de contas dos valores recolhidos e gastos.
Art. 4º - A FAPESP poderá baixar os atos necessários à implementação das atividades de que trata esta Resolução.
Art. 5º - Esta Resolução entra em vigor na data de sua publicação no Diário Oficial da União, devendo ser divulgada no endereço eletrônico do servidor web do CG na Internet: http://www.cg.org.br."
Roberto Pinto Martins
ANEXO
DOMÍNIOS DE PRIMEIRO NÍVEL (DPNs)
Artigo único - Este Anexo fixa os Domínios de Primeiro Nível (DPNs) sob o domínio .br, válidos para o registro de nomes de domínio na rede eletrônica Internet do Brasil.
§ 1º - Constituem Domínios de Primeiro Nível (DPNs) sob o domínio .br:
I - Grupo Pessoa Jurídica:
a) .br, destinado às instituições de ensino superior e às de pesquisa, que se inscrevem diretamente sob este domínio; este DPN "implícito" é equivalente ao ".edu" norte-americano. Exige-se a apresentação do comprovante de inscrição no Cadastro Geral de Contribuintes do Ministério da Fazenda (CGC/MF) e a comprovação da atividade específica;
b) .com, destinado a instituições comerciais. Exige-se o CGC;
c) .org, destinado a organizações não governamentais e sem fins lucrativos.
Exige-se documentação que comprove a natureza da instituição e o CGC. Em casos especiais, a exigência do CGC para esse DPN poderá ser dispensada;
d) .g12, destinado a instituições educacionais de primeiro e segundo grau. Exige-se o CGC;
e) .net, destinado exclusivamente a provedores de meios físicos de comunicação, habilitados legalmente à prestação de serviços públicos de telecomunicações. Exige-se a comprovação desta atividade por documento específico e o CGC;
f) .mil, destinado aos órgãos militares;
g) .gov, destinado ao Governo brasileiro, isto é, aos Três Poderes da República (Executivo, Legislativo e Judiciário), ao Ministério Público Federal, aos Estados e ao Distrito Federal. Excetuados os órgãos da esfera federal, os demais deverão ser alojados sob a sigla do Estado correspondente (ex: al.gov.br , am.gov.br, etc). Exige-se o CGC. Poderá haver dispensa do CGC, se justificada;
h) .art, destinado a instituições dedicadas às artes, artesanato e afins. Exige-se o CGC. Poderá haver dispensa do CGC, se justificada;
i) .esp, destinado a entidades relacionadas a esportes em geral. Exige-se o CGC. Poderá haver dispensa do CGC, se justificada;
j) .ind, destinado a instituições voltadas à atividade industrial. Exige-se o CGC;
l) .inf, destinado aos fornecedores de informação. Exige-se o CGC;
m) .psi, destinado a provedores de serviços Internet em geral. Exige-se o CGC;
n) .rec, destinado a instituições voltadas às atividades de recreação e jogos, em geral. Exige-se o CGC;
o) .tmp, destinado a eventos temporários, de curta duração, como feiras, seminários, etc. Há dispensa do CGC para esta categoria;
p) .etc, destinado a instituições que não se enquadrem nas categorias anteriores. Exige-se o CGC.
II - Grupo Profissionais Liberais, para o qual exige-se a comprovação de inscrição no Cadastro de Pessoas Físicas do Ministério da Fazenda (CPF/MF):
a) .adv, destinado a advogados;
b) .arq, destinado a arquitetos;
c) .eng, destinado a engenheiros;
d) .eti, destinado a especialistas em tecnologia de informação;
e) .jor, destinado a jornalistas;
f) .lel, destinado a leiloeiros;
g) .med, destinado a médicos;
h) .odo, destinado a odontólogos;
i) .psc, destinado a psicólogos;
j) .vet, destinado a veterinários.
III - Grupo Pessoas Físicas, cujo registro será efetuado sob o DPN .nom, exigindo-se para tanto a comprovação de inscrição no Cadastro de Pessoas Físicas do Ministério da Fazenda (CPF/MF) do titular ou do seu responsável.
§ 2º - O DPN de que trata o inciso III (.nom) somente estará disponível para o registro a partir de julho de 1998.
SISTEMA NACIONAL
DE ARMAS - SINARM
CONSOLIDAÇÃO DAS NORMAS
RESUMO: A IN a seguir consolida as normas do Sistema Nacional de Armas - SINARM, e estabelece critérios para o cadastramento das armas de fogo produzidas, importadas e vendidas no País, as transferências de propriedade, o trânsito, o extravio, o furto, o roubo e outras ocorrências suscetíveis de alterar os dados cadastrais, bem como as apreensões de armas, inclusive as vinculadas a procedimentos policiais e judiciais.
INSTRUÇÃO NORMATIVA DPF Nº 4,
de 12.05.98
(DOU de 15.05.98)
Estabelece normas com vistas ao cumprimento do disposto na Lei nº 9.437, de 20 de fevereiro de 1997, que instituiu, no Ministério da Justiça, no âmbito da Polícia Federal, com circunscrição em todo território nacional, o SISTEMA NACIONAL DE ARMAS - SINARM, e no Decreto nº 2.222, de 08 de maio de 1997, no que concerne ao porte federal de arma, autorização para registro, registro federal de arma, transferência, trânsito e cadastramento de arma de fogo.
O DIRETOR-GERAL DO DEPARTAMENTO DE POLÍCIA FEDERAL, no uso das atribuições que lhe são conferidas pelo item III, art. 27 do Regimento Interno, aprovado pela Portaria nº 736, de 10 de dezembro de 1996, do Ministro da Justiça, e tendo em vista o disposto no art. 48 do Decreto nº 2.222, de 08 de maio de 1997, resolve expedir a presente Instrução Normativa (IN).
1 - DA FINALIDADE
1.1 - A presente IN tem por finalidade consolidar as normas do SISTEMA NACIONAL DE ARMAS - SINARM, e estabelecer critérios para o cadastramento das armas de fogo produzidas, importadas e vendidas no País, as transferências de propriedade, o trânsito, o extravio, o furto, o roubo e outras ocorrências suscetíveis de alterar os dados cadastrais, bem como as apreensões de armas, inclusive as vinculadas a procedimentos policiais e judiciais.
2 - OBJETIVO DO SISTEMA
2.1 - O SINARM, cuja competência está estabelecida no art. 2º da Lei nº 9.437, de 20 de fevereiro de 1997, tem por objetivo coletar, processar e disseminar, no âmbito da Polícia Federal, dados indispensáveis ao cadastramento, registro e controle de armas, inclusive as apreendidas, mesmo que vinculadas a procedimentos policiais e judiciais, de uso permitido, restrito ou proibido, bem como a concessão de Porte Federal de Arma.
2.1.1 - Os dados coletados pelo SINARM estarão à disposição dos SFPCs, observado o disposto no art. 49 do Decreto nº 2.222, de 08 de maio de 1997, das Polícias Civis, do Ministério Público e Justiça, cabendo às Superintendências Regionais a responsabilidade pela integração do SISTEMA e pelo intercâmbio de informações.
3 - DO GERENCIAMENTO
3.1 - O SINARM será gerenciado pela COORDENAÇÃO CENTRAL DE POLÍCIA (CCP), através da DIVISÃO DE ORDEM POLÍTICA E SOCIAL (DOPS).
4 - DO PORTE
4.1 - São competentes para autorizar e conceder o Porte Federal de Arma, o Diretor-Geral, o Chefe da Divisão de Ordem Política e Social e os Superintendentes Regionais.
4.2 - O Porte Federal de Arma terá eficácia temporal de até quatro anos.
4.3 - Os Portes Federais de Arma, já expedidos, permanecerão em vigor até expirar a data de sua validade.
4.4 - A taxa estipulada para o Porte Federal de Arma, no valor de R$ 650,00 (seiscentos e cinqüenta reais), art. 9º da Lei nº 9.437/97, somente será cobrada a partir de 1º de janeiro de 1998, em face do disposto no art. 150, inc. III, alínea b, da Constituição Federal, devendo ser recolhida após a análise e aprovação dos documentos apresentados.
4.5 - O Porte Federal de Arma é classificado em duas categorias:
4.5.1 - DEFESA PESSOAL
4.5.2 - FUNCIONAL
4.6 - O Porte Federal de Arma, categoria Defesa Pessoal, será concedido, em caráter excepcional, a brasileiros e a estrangeiros permanentes, maiores de 21 (vinte e um) anos, que atendam aos requisitos constantes dos arts. 13 e 14, ressalvado o disposto no art. 22 do Decreto nº 2.222/97, e apresentem Requerimento SINARM devidamente preenchido.
4.6.1 - Os pedidos de porte de arma de que trata o art. 22 do Decreto nº 2.222/97 serão encaminhados à DOPS/CCP, que providenciará o respectivo processamento.
4.6.2 - A solicitação de Porte Federal de Arma para agentes de segurança de dignitários estrangeiros em visita ao País deverá ser feita com antecedência mínima de dez (10) dias.
4.6.3 - O Porte Federal de Arma somente será expedido para armas de calibre permitido, ressalvado o disposto no art. 22 do Decreto nº 2.222/97, de acordo com especificação contida no Regulamento para a Fiscalização de Produtos Controlados (R-105), do Ministério do Exército.
4.6.4 - Poderão ser expedidos Portes Federais de Arma até o número permitido de armas que, como proprietário, o cidadão tenha direito a possuir.
4.6.5 - O interessado em obter o Porte Federal de Arma deverá requerê-lo junto à Superintendência Regional do DPF, na Unidade da Federação em que residir ou possuir domicílio fiscal.
4.7 - O Porte Federal de Arma, categoria Funcional, será concedido para armas de fogo pertencentes aos Órgãos da Administração Pública Direta ou Indireta e dos Poderes Legislativo e Judiciário e em nome desses expedidos, mediante solicitação de seus titulares.
4.7.1 - O Porte Federal de Arma, categoria Funcional, é restrito a servidores públicos federais pertencentes aos quadros dos órgãos mencionados no subitem 4.7, cuja atividade exija o uso de arma de fogo.
4.7.2 - O órgão interessado em obter o referido documento deverá fazer a solicitação por meio de ofício ao Superintendente Regional, nos Estados e no Distrito Federal, encaminhando o Requerimento - SINARM, devidamente preenchido, acompanhado de cópia do Certificado de Registro de Arma de fogo, cadastrada no SINARM, bem como o comprovante do recolhimento da taxa prevista no inciso VII, do art. 13 do Decreto nº 2.222/97.
4.8 - A concessão de Porte Federal de Arma para Deputados Federais e Senadores, nos termos do art. 29 do Decreto nº 2.222/97, dependerá de autorização do Ministro da Justiça.
4.8.1 - Após a autorização ministerial a Direção-Geral encaminhará o documento à DOPS/CCP, que providenciará junto ao interessado o preenchimento do requerimento SINARM, o comprovante do recolhimento da taxa prevista no inciso VII do art. 13 do Decreto nº 2.222/97 e a cópia do Certificado de Registro de Arma de Fogo, cadastrada no SINARM, para fins de expedição e entrega do porte.
4.9 - A entrega do Porte Federal de Arma ao interessado será controlada através de recibo, no qual serão consignados o número do porte, a data da entrega, o nome e assinatura do recebedor.
4.10 - O Porte Federal de Arma é pessoal, intransferível e essencialmente revogável a qualquer tempo, e o mesmo somente terá validade com a apresentação do documento de identidade do portador.
4.10.1 - Em caso de extravio, furto ou roubo de porte federal de arma, exigir-se-á, para expedição de 2ª via, apresentação do formulário SINARM, devidamente preenchido, e certidão de registro de ocorrência policial lavrada na delegacia de polícia mais próxima ao local do fato.
4.11 - No documento de Porte Federal de Arma, deverá constar, obrigatoriamente, o disposto no art. 17 do Decreto nº 2.222/97.
4.12 - As certidões mencionadas no inciso II do art. 13 do Decreto nº 2.222/97 serão recebidas estritamente dentro do prazo de suas validades, observando-se, para os documentos referidos nos incisos III e IV do mesmo dispositivo legal, o prazo de três (03) meses de validade, a partir da data da expedição.
4.13 - A comprovação de capacidade técnica, constantes do inciso V, do artigo 13 do Decreto nº 2.222/97, será atestada por instrutor de armamento e tiro do quadro da Polícia Federal ou por policial federal com curso de formação profissional ministrado pela Academia Nacional de Polícia.
4.14 - Na aferição da aptidão psicológica (inciso VI, artigo 13 do Decreto nº 2.222/97), o candidato será submetido a testes de instrumentos de aferição psicológica, composta de inventário de personalidade, testes projetivos, expressivos e entrevista estruturada;
4.14.1 - O laudo de avaliação psicológica será elaborado por psicólogo do quadro da Polícia Federal inscrito no Conselho Regional de Psicologia.
4.14.2 - Quando necessário, as autoridades citadas no item 4.1 poderão credenciar psicólogos não pertencentes aos quadros do DPF para a elaboração dos referidos laudos, desde que possuam registro profissional no órgão competente, informando e encaminhando os respectivos currículos ao Setor de Psicologia/ANP.
4.14.3 - Quando da avaliação psicológica for realizada por psicólogo credenciado, as despesas decorrente serão de responsabilidade do examinandº
4.14.4 - O examinando será considerado apto psicologicamente para portar arma de fogo, se estiver posicionado na faixa de normalidade, estrutural e dinâmica da personalidade.
4.14.4.1 - O psicólogo emitirá laudo conclusivo, considerando o candidato APTO ou INAPTO para portar arma de fogo, a fim de fornecer o subsídio necessário para a decisão da autoridade.
4.14.5 - O examinando terá o prazo de quinze (15) dias para recorrer administrativamente do resultado dos exames, contados a partir da data em que tiver conhecimento desse, devendo o recurso ser dirigido à autoridade que indeferiu a concessão do porte de arma.
4.14.6 - O examinando deverá ter livre acesso às informações concernentes aos exames a que se submeteu, por meio de entrevista de devolução, desde que a solicite.
4.14.7 - O examinando somente poderá submeter-se a novos exames 90 (noventa) dias após a data do indeferimento.
4.14.8 - O Setor de Psicologia da Academia Nacional de Polícia manterá o registro das atividades dos psicólogos indicados e credenciados, podendo propor o seu descredenciamento à autoridade competente.
4.14.9 - O psicólogo deverá encaminhar todos os resultados obtidos na avaliação psicológica ao Setor de Psicologia da ANP/DPF, quando do encaminhamento do laudo à autoridade requisitante.
5 - DO REGISTRO
5.1 - O registro de arma de fogo é obrigatório e será precedido de autorização do SINARM e efetuado pelas Polícias Civis dos Estados e do Distrito Federal, na conformidade do disposto no Decreto nº 2.222/97.
5.1.1 - A arma de fogo de uso restrito ou proibido, adquirida por Policial Federal para uso próprio será registrada na DOPS/CCP, devendo as ocorrências de extravio, furto ou roubo do respectivo certificado ser imediatamente comunicadas à DELOPS, para efeito de controle e expedição de 2ª via.
5.1.2 - A solicitação de autorização para registro de arma de fogo, feita pelo órgão especializado da Polícia Civil, deverá conter os dados do interessado e da arma e será recebida pela DELOPS nos Estados e Distrito Federal, que adotará o seguinte procedimento.
I - Quanto à arma:
a) Providenciar, imediatamente, o cadastramento;
b) Se já cadastrada, verificar se há ocorrência sobre furto, roubo, extravio, etc.
c) Havendo assentamento de ocorrência, indeferir o registro;
d) Comunicar o motivo do indeferimento ao órgão solicitante para adoção das medidas legais cabíveis.
II - Quanto ao interessado:
a) Verificar se já possui a quantidade de armas de fogo legalmente permitida;
b) Indeferir o registro, se for enquadrado no item anterior, observando-se o disposto no art. 5º da Lei nº 9.437/97;
c) Consultar o SINPI, SINIC, SINPRO;
d) Havendo assentamento nos Sistemas relacionados no item anterior, relativo a infrações penais cometidas com violência, grave ameaça ou contra a incolumidade pública, indeferir o registro;
e) Comunicar o indeferimento e sua motivação ao órgão solicitante.
5.1.3- Inexistindo comunicação com o órgão da Polícia Civil por meio magnético, essa será feita por intermédio de ofício, fax, telex, etc, tanto para solicitação quanto para autorização.
6 - DA TRANSFERÊNCIA
6.1 - A transferência de arma de fogo, de uso restrito ou proibido, entre Policiais Federais, será feita a qualquer tempo e precedida de autorização do Superintendente Regional do DPF, da Unidade de lotação do servidor cedente e do Chefe da DOPS/CCP, quando lotado em Órgão Central.
7 - DO TRÂNSITO
7.1 - A autorização para trânsito de arma de fogo, de uso permitido, de uma Unidade para outra da Federação, ressalvada a competência do Chefe da DOPS/CCP, será concedida pelo Chefe da DELOPS ou pelo Chefe da Delegacia de Polícia Federal, exceto se pertencer a militar das forças armadas, caçador, atirador ou colecionador. (Anexo I)
7.1.1 - A autorização de trânsito de arma de fogo somente será concedida à arma registrada e cadastrada no SINARM.
7.1.2 - A guia de trânsito expedida será consignada no SINARM.
8 - DO CADASTRAMENTO
8.1 - A forma de cadastramento das armas de fogo saídas do estoque das fábricas será definida pela DOPS/CCP e COINF, após estudo em conjunto com aquelas, procedendo-se da mesma maneira junto às Polícias Civis com relação à integralização dos acervos de registros de armas de fogo já existentes.
8.2 - A DOPS/CCP e a COINF ficam encarregadas de interagir com a Secretaria da Receita Federal, a fim de viabilizar o fluxo de informações relativas às importações de armas de fogo, por intermédio do SISCOMEX.
8.3 - As transferências de propriedade, o extravio, o furto, o roubo e outras ocorrências suscetíveis de alterar os dados cadastrais já existentes, bem como, as armas apreendidas, inclusive as vinculadas a procedimentos policiais e judiciais, assim como sua destinação, serão cadastradas pela DELOPS nos Estados e Distrito Federal.
9 - DAS DISPOSIÇÕES GERAIS
9.1 - Fica instituído o formulário REQUERIMENTO - SINARM destinado para Registro, Transferência, Apreensão, Furto, Roubo, Extravio, Remessa ao SFPC e Recuperaç㺠(Anexo II)
9.2 - A DOPS/CCP, dentro de 60 (sessenta) dias, estabelecerá o modelo de Certificado de Registro Federal de Arma de Fogo, bem como os novos modelos de requerimento e de Porte Federal de Arma, que serão submetidos à apreciação e aprovação da Direção-Geral.
9.3 - A COINF elaborará o "Manual do Usuário do SINARM", em articulação com a DOPS/CCP.
9.4 - A DOPS/CCP expedirá Instrução de Serviço com vistas à orientação dos procedimentos para o eficaz funcionamento do SINARM.
9.5 - Esta IN entra em vigor na data de sua publicação.
9.6 - Ficam revogadas as Portarias nºs 222 e 223 e a Instrução de Serviço nº 001, datadas de 12 de março de 1987 e a IN nº 004/DG/DPF, de 29 de agosto de 1997.
Vicente Chelotti


VIGILÂNCIA
SANITÁRIA
REGULAMENTO TÉCNICO SOBRE SUBSTÂNCIAS E MEDICAMENTOS SUJEITOS A CONTROLE ESPECIAL
RESUMO: A Portaria a seguir aprova o Regulamento Técnico sobre substâncias e medicamentos sujeitos a controle especial.
PORTARIA SVS Nº 344, de 12.05.98
(DOU de 15.05.98)
A SECRETÁRIA DE VIGILÂNCIA SANITÁRIA DO MINISTÉRIO DA SAÚDE, no uso de suas atribuições e considerando a Convenção Única sobre Entorpecentes de 1961 (Decreto nº 54.216/64), a Convenção sobre Substâncias Psicotrópicas, de 1971 (Decreto nº 79.388/77), a Convenção Contra o Tráfico Ilícito de Entorpecentes e Substâncias Psicotrópicas, de 1988 (Decreto nº 154/91), o Decreto-Lei nº 891/38, o Decreto-Lei nº 157/67, a Lei nº 6.368/76 e o Decreto nº 78.992/76,
RESOLVE:
Aprovar o Regulamento Técnico sobre substâncias e medicamentos sujeitos a controle especial.
CAPÍTULO I
DAS DEFINIÇÕES
Art 1º - Para os efeitos deste Regulamento e para a sua adequada aplicação, são adotadas as seguintes definições:
Autorização Especial - Licença concedida a empresas, instituições e órgãos pela Secretaria de Vigilância Sanitária do Ministério da Saúde (SVS/MS), para o exercício de atividades de extração, produção, transformação, fabricação, fracionamento, manipulação, embalagem, reembalagem, importação e exportação das substâncias constantes das listas anexas a este Regulamento, bem como dos medicamentos que as contenham.
CAS - Chemical Abstracts Service.
Autorização de Exportação - Documento expedido pela Secretaria de Vigilância Sanitária do Ministério da Saúde (SVS/MS), que consubstancia a exportação de substâncias constantes das listas "A1" e "A2" (entorpecentes), "A3", "B1" e "B2" (psicotrópicas) e "D1" (precursores) deste Regulamento ou de suas atualizações, bem como os medicamentos que as contenham.
Autorização de Importação - Documento expedido pela Secretaria de Vigilância Sanitária do Ministério da Saúde (SVS/MS), que consubstancia a importação de substâncias constantes das listas "A1" e "A2" (entorpecentes), "A3", "B1" e "B2" (psicotrópicas) e "D1" (precursores) deste Regulamento ou de suas atualizações, bem como os medicamentos que as contenham.
Certificado de Autorização Especial - Documento expedido pela Secretaria de Vigilância Sanitária do Ministério da Saúde (SVS/MS), que consubstancia a concessão da Autorização Especial.
Certificado de Não-Objeção - Documento expedido pelo órgão competente do Ministério da Saúde do país importador, certificando que a substância ou medicamento objeto da importação não está sob controle especial naquele país.
CID - Classificação Internacional de Doenças.
Cota Anual de Importação - Quantidade de substância constante das listas "A1" e "A2" (entorpecentes), "A3", "B1" e "B2" (psicotrópicas) e "D1" (precursoras) deste Regulamento ou de suas atualiza-ções que a empresa é autorizada a importar até o 1º (primeiro) trimestre do ano seguinte a sua concessão.
Cota Suplementar de Importação - Quantidade de substância constante das listas "A1" e "A2" (entorpecentes), "A3", "B1" e "B2" (psicotrópicas) e "D1" (precursoras) deste Regulamento ou de suas atualizações, que a empresa é autorizada a importar, em caráter suplementar à cota anual, nos casos em que ficar caracterizada sua necessidade adicional, para o atendimento da demanda interna dos serviços de saúde, ou para fins de exportação.
Cota Total Anual de Importação - Somatório das Cotas Anual e Suplementar autorizadas para cada empresa, no ano em curso.
DCB - Denominação Comum Brasileira.
DCI - Denominação Comum Internacional.
Droga - Substância ou matéria-prima que tenha finalidade medicamentosa ou sanitária.
Entorpecente - Substância que pode determinar dependência física ou psíquica relacionada, como tal, nas listas aprovadas pela Convenção Única sobre Entorpecentes, reproduzidas nos anexos deste Regulamento.
Licença de Funcionamento - Permissão concedida pelo órgão de saúde competente dos Estados, Municípios e Distrito Federal, para o funcionamento de estabelecimento vinculado a empresa que desenvolva qualquer das atividades enunciadas no artigo 2º deste Regulamento.
Livro de Registro Específico - Livro destinado à anotação, em ordem cronológica, de estoques, de entradas (por aquisição ou produção), de saídas (por venda, processamento, uso) e de perdas de medicamentos sujeitos ao controle especial.
Livro de Receituário Geral - Livro destinado ao registro de todas as preparações magistrais manipuladas em farmácias.
Medicamento - Produto farmacêutico, tecnicamente obtido ou elaborado, com finalidade profilática, curativa, paliativa ou para fins de diagnóstico.
Notificação de Receita - Documento padronizado destinado à notificação da prescrição de medicamentos: a) entorpecentes (cor amarela), b) psicotrópicos (cor azul) e c) retinóides de uso sistêmico e imunossupressores (cor branca). A Notificação concernente aos dois primeiros grupos (a e b) deverá ser firmada por profissional devidamente inscrito no Conselho Regional de Medicina, no Conselho Regional de Medicina Veterinária ou no Conselho Regional de Odontologia; a concernente ao terceiro grupo (c), exclusivamente por profissional devidamente inscrito no Conselho Regional de Medicina.
Precursores - Substâncias utilizadas para a obtenção de entorpecentes ou psicotrópicos e constantes das listas aprovadas pela Convenção Contra o Tráfico Ilícito de Entorpecentes e de Substâncias Psicotrópicas, reproduzidas nos anexos deste Regulamento.
Preparação Magistral - Medicamento preparado mediante manipulação em farmácia, a partir de fórmula constante de prescrição médica.
Psicotrópico - Substância que pode determinar dependência física ou psíquica e relacionada, como tal, nas listas aprovadas pela Convenção sobre Substâncias Psicotrópicas, reproduzidas nos anexos deste Regulamento.
Receita - Prescrição escrita de medicamento, contendo orientação de uso para o paciente, efetuada por profissional legalmente habilitado, quer seja de formulação magistral ou de produto industrializado.
Substância Proscrita - Substância cujo uso está proibido no Brasil.
CAPITULO II
DA AUTORIZAÇÃO
Art 2º - Para extrair, produzir, fabricar, beneficiar, preparar, manipular, fracionar, importar, exportar, transformar, embalar, reembalar, para qualquer fim, as substâncias constantes das listas deste Regulamento (ANEXO I) e de suas atualizações, ou os medicamentos que as contenham, é obrigatória a obtenção de Autorização Especial concedida pela Secretaria de Vigilância Sanitária do Ministério da Saúde.
§ 1º - A petição de Autorização Especial será protocolizada junto à Autoridade Sanitária local.
§ 2º - A Autoridade Sanitária local procederá a inspeção do(a) estabelecimento(s) vinculado(s) à empresa postulante de Autorização Especial de acordo com os roteiros oficiais pré-estabelecidos, para avaliação das respectivas condições técnicas e sanitárias, emitindo parecer sobre a petição e encaminhando o respectivo relatório à Secretaria de Vigilância Sanitária do Ministério da Saúde.
§ 3º - No caso de deferimento da petição, a Secretaria de Vigilância Sanitária do Ministério da Saúde enviará o competente Certificado de Autorização Especial a empresa requerente e informará a decisão à Autoridade Sanitária local competente.
§ 4º - As atividades mencionadas no caput deste artigo somente poderão ser iniciadas após a publicação da respectiva Autorização Especial no Diário Oficial da União.
§ 5º - As eventuais alterações de nomes de dirigentes, inclusive de responsável técnico bem como de atividades constantes do Certificado de Autorização Especial serão solicitadas mediante o preenchimento de formulário específico à Autoridade Sanitária local, que o encaminhará à Secretaria de Vigilância Sanitária do Ministério da Saúde.
§ 6º - As atividades realizadas pelo comércio atacadista, como armazenar, distribuir, transportar, bem como, a de manipulação por farmácias magistrais das substâncias e medicamentos de que trata o caput deste artigo, ficam sujeitas a autorização especial do Ministério da Saúde e a licença de funcionamento concedida pela Autoridade Sanitária local.
Art. 3º - A petição de concessão de Autorização Especial deverá ser instruída com os seguintes documentos e informações:
a) cópia da publicação, em Diário Oficial da União, da Autorização de Funcionamento da Empresa;
b) cópia da Licença de Funcionamento, quando se tratar de farmácia, distribuidora ou transportadora;
c) comprovante de pagamento do respectivo preço público, ou documento que justifique sua isenção;
d) cópia do ato constitutivo da empresa e suas eventuais alterações;
e) instrumento de mandato, outorgado pelo representante legal da empresa a procurador com poderes para requerer a concessão de Autorização Especial, quando for o caso;
f) cópia do documento de inscrição no Cadastro Geral de Contribuintes;
g) dados gerais da empresa: razão social, representante legal, endereço completo, nºs de telefone, fax, telex e E.mail, nome do Farmacêutico ou do Químico Responsável Técnico, e nº de sua Inscrição no respectivo Conselho Regional;
h) cópia da Carteira de Identidade e do CIC dos diretores ;
i) prova de habilitação legal, junto ao respectivo Conselho Regional, do farmacêutico ou químico, responsável técnico;
j) relação das substâncias ou medicamentos objeto da atividade a ser autorizada com indicação dos nomes (DCB ou químico) a serem utilizados e da estimativa das quantidades a serem inicialmente trabalhadas;
l) cópia do Manual ou Instruções concernentes às Boas Práticas de Fabricação ou de Manipulação adotado pela empresa.
§ 1º - A eventual mudança do endereço, comercial ou industrial, do detentor da Autorização Especial, deverá ser imediatamente informada para fins de nova inspeção e subsequente autorização se julgada cabível à Autoridade Sanitária local que a encaminhará à Secretaria de Vigilância Sanitária do Ministério da Saúde.
§ 2º - A mudança de C.G.C. exceto por incorporação de empresas, obriga a solicitação de nova Autorização Especial, obedecido o disposto no caput deste artigo e suas alíneas.
§ 3º - No caso de incorporação de empresas, será obrigatório o pedido de cancelamento da Autorização Especial de Funcionamento da empresa cujo C.G.C. tenha sido desativado.
Art 4º - Ficam proibidas a produção, fabricação, importação, exportação, comércio e uso de substâncias e medicamentos proscritos.
Parágrafo único - Excetuam-se da proibição de que trata o caput deste artigo, as atividades exercidas por Órgãos e Instituições autorizados pela Secretaria de Vigilância Sanitária do Ministério da Saúde com a estrita finalidade de desenvolver pesquisas e trabalhos médicos e científicos.
Art 5º - A Autorização Especial é também obrigatória para as atividades de plantio, cultivo, e colheita de plantas das quais possam ser extraídas substâncias entorpecentes ou psicotrópicas.
§ 1º - A Autorização Especial, de que trata o caput deste artigo, somente será concedida à pessoa jurídica de direito público que tenha por objetivo o estudo, a pesquisa, a extração ou a utilização de princípios ativos obtidos daquelas plantas.
§ 2º - A concessão da Autorização Especial, prevista no caput deste artigo, deverá seguir os mesmos procedimentos constantes dos parágrafos 1º, 2º, e 3º do artigo 2º deste Regulamento, e será requerida pelo dirigente do órgão ou instituição responsável pelo plantio, colheita e extração de princípios ativos de plantas, instruído o processo com os seguintes documentos:
a) petição, conforme modelo padronizado;
b) plano ou programa completo da atividade a ser desenvolvida;
c) indicação das plantas, sua família, gênero, espécie e variedades e, se houver, nome vulgar;
d) declaração da localização, da extensão do cultivo e da estimativa da produção;
e) especificação das condições de segurança;
f) endereço completo do local do plantio e da extração;
g) relação dos técnicos que participarão da atividade, comprovada sua habilitação para as funções indicadas.
§ 3º - As autoridades sanitárias competentes dos Estados, dos Municípios e do Distrito Federal terão livre acesso aos locais de plantio ou cultura, para fins de fiscalização.
Art 6º - A Secretaria de Vigilância Sanitária do Ministério da Saúde dará conhecimento da concessão da Autorização Especial de que tratam os artigos 2º e 5º deste Regulamento à Divisão de Repressão a Entorpecentes do Departamento de Policia Federal do Ministério da Justiça.
Art 7º -A concessão de Autorização Especial à estabelecimentos que realizam pesquisas e trabalhos médicos e científicos de que trata o parágrafo único do artigo 4º deste Regulamento, deverá ser requerida pelo seu dirigente, mediante petição instruída com os seguintes documentos:
a) cópia da Carteira de Identidade e CIC do dirigente do estabelecimento;
b) documento firmado pelo dirigente do estabelecimento identificando o profissional responsável pelo controle e guarda das substâncias e medicamentos utilizados e os pesquisadores participantes;
c) cópia da carteira de identidade e CIC das pessoas mencionadas no item b;
d) cópia do plano integral do curso ou pesquisa técno-científico;
e) relação dos nomes das substâncias ou medicamentos com indicação das quantidades respectivas a serem utilizadas na pesquisa ou trabalho.
Parágrafo único - Deverá ser comunicada à Autoridade Sanitária local qualquer mudança de Dirigente ou de responsáveis mencionados nas alíneas b e c, deste artigo.
Art 8º - Ficam isentos de Autorização Especial as empresas, instituições e órgãos na execução das seguintes atividades e categorias a eles vinculadas:
I - Unidades de Saúde que somente dispensem medicamentos objeto deste Regulamento, em suas embalagens originais, adquiridos no mercado nacional;
II - Órgãos de Repressão a Entorpecentes;
III - Laboratórios de Análises Clínicas que utilizem substâncias objeto deste Regulamento unicamente com finalidade diagnóstica.
IV - Laboratórios de Referência que utilizem substâncias objeto deste Regulamento na realização de provas analíticas para identificação de drogas.
Parágrafo único - A isenção da Autorização Especial para estabelecimentos constantes dos incisos III e IV, deste artigo, deverá ser requerida pelo seu dirigente, com petição acompanhada dos seguintes documentos:
a) cópia de Carteira de Identidade e CIC do dirigente do estabelecimento;
b) documento firmado pelo dirigente do estabelecimento indicando o profissional responsável pelo controle e guarda das substâncias/medicamentos utilizados;
c) cópia da carteira de identidade do responsável mencionado no item b;
d) cópia do Programa de Trabalho;
e) relação das substâncias ou medicamentos objeto deste Regulamento utilizados pelos laboratórios de análise clínica ou de referência com indicação das quantidades a serem utilizadas anualmente.
Art 9º - A solicitação de cancelamento da Autorização Especial, por parte da empresa, deverá ser feita mediante petição conforme modelo padronizado, instruindo documentos constantes da Instrução Normativa deste Regulamento.
Art 10 - Poderá ser suspensa ou cancelada a Autorização Especial pela Secretaria de Vigilância Sanitária do Ministério da Saúde, quando ficar comprovada irregularidade que configure infração sanitária praticada pelo estabelecimento conforme o disposto na legislação em vigor.
§ 1º - No caso de cancelamento ou suspensão da Autorização Especial, o infrator deve obrigatoriamente apresentar às Autoridades Sanitárias Estaduais, Municipais ou do Distrito Federal, com vistas ao conhecimento da Secretaria de Vigilância Sanitária do Ministério da Saúde, informações sobre o estoque remanescente de quaisquer substâncias integrantes das listas deste Regulamento e de suas atualizações, bem como dos medicamentos que as contenham.
§ 2º - Caberá à Autoridade Sanitária local decidir quanto ao destino dos estoques de substâncias ou medicamentos em poder do estabelecimento, cuja Autorização Especial tenha sido suspensa ou cancelada.
CAPÍTULO III
DO COMÉRCIO
Art 11 - A empresa importadora fica obrigada a solicitar à Secretaria de Vigilância Sanitária do Ministério da Saúde, a fixação de Cota Anual de Importação de substâncias constantes das listas "A1" e "A2" (entorpecentes), "A3", "B1" e "B2" ( psicotrópicas) "D1" (precursoras) deste Regulamento e de suas atualizações, requeridas até 30 (trinta) de novembro de cada ano, para uso no ano seguinte.
§ 1º - A Secretaria de Vigilância Sanitária do Ministério da Saúde deverá pronunciar-se sobre a liberação da cota anual até no máximo 30 (trinta) de abril do ano seguinte.
§ 2º - A cota de importação autorizada poderá ser importada de uma só vez, ou parceladamente.
Art 12 - Excepcionalmente a empresa, quando devidamente justificado, poderá solicitar Cota Suplementar, das substâncias constantes das listas citadas no artigo anterior, devendo sua entrada, no país, ocorrer até o final do 1º trimestre do ano seguinte da sua concessão.
§ 1º - A empresa importadora deverá requerer ao Ministério da Saúde a cota suplementar e a Autorização de Importação, no mesmo ato, até no máximo 30 de novembro de cada ano.
§ 2º - A Secretaria de Vigilância Sanitária do Ministério da Saúde enviará às unidades federadas e à Vigilância Sanitária de Portos, Aeroportos e Fronteiras, para conhecimento, relação das cotas e das eventuais alterações concedidas.
Art 13 - Para importar e exportar substâncias constantes das listas deste Regulamento e de suas atualizações bem como os medicamentos que as contenham, a empresa dependerá de anuência prévia da Secretaria de Vigilância Sanitária do Ministério da Saúde, na L.I. - Licenciamento de Importação ou R.O.E. - Registro de Operações de Exportação, emitida em formulário próprio ou por procedimento informatizado.
Parágrafo único - A Secretaria de Vigilância Sanitária do Ministério da Saúde deverá remeter uma via do documento de Importação e/ou Exportação à Autoridade Sanitária competente do Estado ou Distrito Federal em que estiver sediado o estabelecimento.
Art 14 - A importação de substâncias constantes das listas "A1" e "A2" (entorpecentes), das listas "A3", "B1" e "B2" (psicotrópicas) e da lista "D1" (precursoras), incluídas neste Regulamento e nas suas atualizações, e os medicamentos que as contenham, dependerá da emissão de Autorização de Importação (ANEXO II) da Secretaria de Vigilância Sanitária do Ministério da Saúde.
§ 1º - Independem da emissão de Autorização de Importação as substâncias das listas "C1", "C2", "C4" e "C5" (outras substâncias sujeitas a controle especial, retinóicos, anti-retrovirais e anabolizantes, respectivamente) bem como os medicamentos que as contenham. A Secretaria de Vigilância Sanitária do Ministério da Saúde emitirá o Certificado de Não Objeção (ANEXO III) quando a substância ou medicamento não for controlado no Brasil, porém for controlado no país exportador.
§ 2º - No caso de importação parcelada, para cada parcela da cota anual será emitida uma Autorização de Importação.
Art 15 - Deferida a cota anual de importação, a empresa interessada deverá requerer a Autorização de Importação, até 31 (trinta e um) de outubro de cada ano.
Art 16 - A Autorização de Importação e o Certificado de Não Objeção, ambos de caráter intransferível, serão expedidos em 6 (seis) e 5 (cinco) vias, respectivamente, podendo os mesmos serem emitidos por processo informatizado, ou não, os quais terão a seguinte destinação:
Parágrafo único - A empresa se incumbirá do encaminhamento das vias aos órgãos competentes.
Art 17 - A Autorização de Importação da cota anual e da cota suplementar terá validade até o 1º (primeiro) trimestre do ano seguinte da sua emissão.
Art 18 - Para exportar, o interessado devidamente habilitado perante a Secretaria de Vigilância Sanitária do Ministério da Saúde, e ao Órgão equivalente do Estado e Distrito Federal deverá requerer a Autorização de Exportação (ANEXO IV), devendo ainda apresentar a Autorização expedida pelo órgão competente do país importador.
Art 19 - A Autorização de Exportação, de caráter intransferível, será expedida em 6 (seis) vias, podendo ser emitidas por processo informatizado, ou não, com a seguinte destinação:
Parágrafo único - A empresa se incumbirá do encaminhamento das vias aos órgãos competentes.
Art 20 - A importação e exportação da substância da lista "C3" (imunosupressoras) Ftalimidoglutarimida (Talidomida), seguirá o previsto em legislação sanitária específica em vigor.
Art 21 - Para o desembaraço aduaneiro e inspeção da mercadoria pela Repartição Aduaneira, a empresa interessada deverá apresentar, no local, junto a respectiva Autoridade Sanitária, toda a documentação necessária definida em Instrução Normativa deste Regulamento.
§ 1º - Para importação, cada despacho deverá ser liberado mediante a apresentação de 5 (cinco) vias da "Guia de Retirada de Substâncias/Medicamentos Entorpecentes ou que determinem Dependência Física ou Psíquica", conforme modelo (ANEXO V) deste Regulamento.
§ 2º - Independem da emissão da "Guia de Retirada de Substâncias/Medicamentos Entorpecentes ou que determinem Dependência Física ou Psíquica", as substâncias constantes das listas "C1" (outras substâncias sujeitas a controle especial), "C2" (retinóicas), "C4" (anti-retrovirais) e "C5" (anabolizantes), deste Regulamento e de suas atualizações, bem como os medicamentos que as contenham.
Art 22 - As importações e exportações das substâncias das listas "A1" e "A2" (entorpecentes), "A3", "B1" e "B2" (psicotrópicas) e lista "D1" (precursoras) deste Regulamento e de suas atualizações, bem como os medicamentos que as contenham, só poderão ingressar no país e serem liberadas através dos respectivos Serviços de Vigilância Sanitária do Porto ou Aeroporto Internacional do Rio de Janeiro ou de outros Estados que venham a ser autorizados pelo Ministério da Saúde, em conjunto com outros órgãos envolvidos.
Art 23 - Os estabelecimentos que necessitem importar substâncias constantes das listas deste Regulamento e de suas atualizações, para fins de ensino ou pesquisa, análise e padrões de referência utilizados em controle de qualidade, após cumprirem o disposto nos artigos 14, 15 e 16, deverão importar de uma só vez a quantidade autorizada.
Art 24 - As compras e/ou vendas ou transferências de substâncias constantes das listas "A1" e "A2" (entorpecentes), "A3", "B1" e "B2" (psicotrópicas), "C3" (Imunossupressoras) e "D1" (precursoras) deste Regulamento e suas atualizações, e os medicamentos que contenham, as substâncias das listas "A1" e "A2" (entorpecentes), "A3" e "B2" (psicotrópicos) e "C3" (Imunossupressoras), deverão ser acompanhadas de Nota Fiscal ou Nota Fiscal Fatura, visada pela Autoridade Sanitária do local de domicílio do remetente.
§ 1º - O visto será aplicado mediante carimbo próprio da Autoridade Sanitária, no anverso da Nota Fiscal ou Nota Fiscal Fatura, preenchido com o nº de ordem, que poderá ser aposto em forma de carimbo ou etiqueta, constando local, data , nome e assinatura do responsável. Este visto terá validade de 60 (sessenta) dias.
§ 2º - Somente as empresas ou estabelecimentos devidamente legalizados junto à Secretaria de Vigilância Sanitária do Ministério da Saúde, poderão efetuar compra, venda ou transferência de substâncias constantes das listas deste Regulamento e de suas atualizações, bem como dos seus respectivos medicamentos.
§ 3º - A Autoridade Sanitária do Estado, do Município ou do Distrito Federal manterá sistema de registro da Nota Fiscal ou Nota Fiscal Fatura, visada, que permita um efetivo controle sobre as mesmas.
§ 4º - Fica a empresa emitente obrigada a solicitar o cancelamento da Nota Fiscal ou Nota Fiscal Fatura, já visada, junto à Autoridade Sanitária competente, quando não for efetivada a transação comercial.
Art 25 - As compras, vendas ou transferências das substâncias das listas "C1" (outras substâncias sujeitas a controle especial), "C2" (retinóicas), "C4" (anti-retrovirais) e "C5" (anabolizantes) bem como os medicamentos que contenham substâncias das listas "B1" (psicotrópicas), "C1" (outras substâncias sujeitas a controle especial), "C2" (retinóicas), "C4" (anti-retrovirais), "C5" (anabolizantes) e "D1" (precursoras), deste Regulamento e de suas atualizações, estão isentas do visto da Autoridade Sanitária local, no documento comprovante da transação comercial.
Parágrafo único - As vendas de medicamentos a base da substância Misoprostol constante da lista "C1" (outras substâncias sujeitas a controle especial) deste Regulamento, ficarão restritas a estabelecimentos hospitalares devidamente cadastrados e credenciados junto a Autoridade Sanitária competente.
Art 26 - A Nota Fiscal ou Nota Fiscal Fatura de venda ou transferência de substâncias constantes das listas deste Regulamento e suas atualizações, bem como os medicamentos que as contenham, deverá distingui-los, após o nome respectivo, através de colocação entre parênteses, da letra indicativa da lista a que se refere.
Parágrafo único - A Nota Fiscal ou Nota Fiscal Fatura que contenha substância da lista "C3" (imunossupressoras) ou do medicamento Talidomida não poderá conter outras substâncias ou produtos.
Art. 27 - A devolução de substâncias constantes das listas "A1" e "A2" (entorpecentes), "A3", "B1" e "B2" (psicotrópicas), "C3" (imunossupressoras) e "D1" (precursoras), deste Regulamento e de suas atualizações e dos medicamentos que contenham substâncias das listas "A1" e "A2" (entorpecentes) e "A3", "B1" e "B2" (psicotrópicas) e "C3" (imunossupressoras), deverá ser acompanhada de Nota Fiscal de devolução, visada pela Autoridade Sanitária local da empresa responsável pela devolução.
Parágrafo único - A Autoridade Sanitária que visar a Nota Fiscal ou Nota Fiscal Fatura de devolução, deverá informar, por escrito, às demais Autoridades Sanitárias envolvidas.
Art 28 - O estoque de substâncias e medicamentos de que trata este Regulamento não poderá ser superior as quantidades previstas para atender as necessidades de 6 (seis) meses de consumo.
§ 1º - O estoque de medicamentos destinados à Programas Especiais do Sistema Único de Saúde não está sujeito as exigências previstas no caput deste artigo.
§ 2º - O estoque das substâncias da lista "C3" (imunossupressoras) e do medicamento Talidomida não poderá ser superior as quantidades previstas para 1(um) ano de consumo.
Art 29 - A venda em farmácias e drogarias de medicamentos de uso sistêmico a base de substâncias constantes da lista "C2" (retinóicas), só poderá ser realizada mediante o cadastramento prévio efetuado pela Autoridade Sanitária Estadual.
Art 30 - Fica proibida a manipulação em farmácias das substâncias constantes da lista "C2" (retinóicas), na preparação de medicamentos de uso sistêmico, e de medicamentos a base das substâncias constantes da lista "C3" (imunossupressoras) deste Regulamento e de suas atualizações.
Art 31 - A manipulação de substâncias retinóicas (lista "C2" deste Regulamento e de suas atualizações), na preparação de medicamentos de uso tópico, somente, será realizada por farmácias que sejam certificadas em Boas Práticas de Manipulação e Controle (BPM e C).
§ 1º - O Certificado de BPM e C do que trata o caput deste artigo será concedido pela Autoridade Sanitária competente dos Estados, Municípios e Distrito Federal.
§ 2º - A Secretaria de Vigilância Sanitária do Ministério da Saúde no prazo de 90 (noventa) dias harmonizará e regulamentará a Boas Práticas de Manipulação e Controle (BPM e C), no âmbito nacional.
CAPÍTULO IV
DO TRANSPORTE
Art 32 - A transportadora de substâncias constantes das listas deste Regulamento e de suas atualizações e dos medicamentos que as contenham, deverá estar devidamente legalizada junto aos órgãos competentes.
Art 33 - O transporte de substâncias constantes das listas deste Regulamento e de suas atualizações ou dos medicamentos que as contenham ficará sob a responsabilidade solidária das empresas remetente e transportadora, para todos os efeitos legais.
§ 1º - A transportadora deverá manter, em seu arquivo, cópia autenticada da Autorização Especial das empresas para as quais presta serviços.
§ 2º - É vedado o transporte de medicamentos a base de substâncias, constantes das listas deste Regulamento e de suas atualizações, por pessoa física, quando de sua chegada ou saída no país, em viagem internacional, sem a devida cópia da prescrição médica.
Art 34 - As substâncias constantes das listas deste Regulamento e de suas atualizações, bem como os medicamentos que as contenham, quando em estoque ou transportadas sem documento hábil, serão apreendidas, incorrendo os portadores e mandatários nas sanções administrativas previstas na legislação sanitária, sem prejuízo das sanções civis e penais.
Parágrafo único - Após o trâmite administrativo, a Autoridade Sanitária local deverá encaminhar cópia do processo à Autoridade Policial competente, quando se tratar de substâncias constantes das listas "A1", "A2" (entorpecentes) , "A3", "B1" e "B2" (psicotrópicas) e "D1" (precursoras) e dos medicamentos que as contenham
Art 35 - É vedada a dispensação e o comércio de substâncias constantes das listas deste Regulamento e de suas atualizações, bem como dos seus respectivos medicamentos, por sistema de reembolso postal e aéreo, e por oferta através de outros meios de comunicação, mesmo com a receita médica.
Parágrafo único - Estão isentos do previsto no caput deste artigo, os medicamentos a base de substâncias constantes da lista "C4" (anti-retrovirais) e de suas atualizações.
CAPÍTULO V
DA PRESCRIÇÃO
DA NOTIFICAÇÃO DE RECEITA
Art 36 - A Notificação de Receita é o documento que acompanhado de receita autoriza a dispensação de medicamentos a base de substâncias constantes das listas "A1" e "A2" (entorpecentes), "A3", "B1" e "B2" (psicotrópicas), "C2" (retinóicas para uso sistêmico) e "C3" (imunossupressoras), deste Regulamento e de suas atualizações.
§ 1º - Caberá à Autoridade Sanitária, fornecer ao profissional ou instituição devidamente cadastrados, o talonário de Notificação de Receita "A", e a numeração para confecção dos demais talonários, bem como avaliar e controlar esta numeração.
§ 2º - A reposição do talonário da Notificação de Receita "A" ou a solicitação da numeração subsequente para as demais Notificações de Receita, se fará mediante requisição (ANEXO VI), devidamente preenchida e assinada pelo profissional.
§ 3º - A Notificação de Receita deverá estar preenchida de forma legível, sendo a quantidade em algarismos arábicos e por extenso, sem emenda ou rasura.
§ 4º - A farmácia ou drogaria somente poderá aviar ou dispensar quando todos os itens da receita e da respectiva Notificação de Receita estiverem devidamente preenchidos.
§ 5º - A Notificação de Receita será retida pela farmácia ou drogaria e a receita devolvida ao paciente devidamente carimbada, como comprovante do aviamento ou da dispensação.
§ 6º - Não será exigida a Notificação de Receita para pacientes internados nos estabelecimentos hospitalares, médico ou veterinário, oficiais ou particulares, porém a dispensação se fará mediante receita ou outro documento equivalente (prescrição diária de medicamento), subscrita em papel privativo do estabelecimento.
§ 7º - A Notificação de Receita é personalizada e intransferível, devendo conter somente uma substância das listas "A1" e "A2" (entorpecentes) e "A3" , "B1" e "B2" (psicotrópicas), "C2" (retinóides de uso sistêmico) e "C3" (imunossupressoras) deste Regulamento e de suas atualizações, ou um medicamento que as contenham.
§ 8º - Todas as vezes que for prescrito o medicamento Talidomida, lista "C3", o paciente deverá receber, juntamente com o medicamento, o "Termo de Esclarecimento" (ANEXO VII) bem como deverá ser preenchido e assinado um "Termo de Responsabilidade" (ANEXO VIII) pelo médico que prescreveu a Talidomida, em duas vias, devendo uma via ser encaminhada à Coordenação Estadual do Programa, conforme legislação sanitária específica em vigor e a outra permanecer no prontuário do paciente.
Art 37 - A Notificação de Receita conforme o anexo IX (modelo de talonário oficial "A", para as listas "A1", "A2" e "A3"), anexo X (modelo de talonário - "B", para as listas "B1" e "B2"), anexo XI (modelo de talonário - "B" uso veterinário para as listas "B1" e "B2"), anexo XII (modelo para os retinóides de uso sistêmico, lista "C2") e anexo XIII (modelo para a Talidomida, lista "C3") deverá conter os itens referentes as alíneas a, b e c devidamente impressos e apresentando as seguintes características:
a) sigla da Unidade da Federação;
b) identificação Numérica:
- a seqüência numérica será fornecida pela Autoridade Sanitária competente dos Estados, Municípios e Distrito Federal;
c) identificação do emitente:
- nome do profissional com sua inscrição no Conselho Regional com a sigla da respectiva Unidade da Federação; ou nome da instituição, endereço completo e telefone;
d) identificação do usuário: nome e endereço completo do paciente, e no caso de uso veterinário, nome e endereço completo do proprietário e identificação do animal;
e) nome do medicamento ou da substância: prescritos sob a forma de Denominação Comum Brasileira (DCB), dosagem ou concentração, forma farmacêutica, quantidade (em algarismos arábicos e por extenso) e posologia;
f) símbolo indicativo: no caso da prescrição de retinóicos deverá conter um símbolo de uma mulher grávida, recortada ao meio, com a seguinte advertência: "Risco de graves defeitos na face, nas orelhas, no coração e no sistema nervoso do feto";
g) data da emissão;
h) assinatura do prescritor: quando os dados do profissional estiverem devidamente impressos no campo do emitente, este poderá apenas assinar a Notificação de Receita. No caso de o profissional pertencer a uma instituição ou estabelecimento hospitalar, deverá identificar a assinatura com carimbo, constando a inscrição no Conselho Regional, ou manualmente, de forma legível;
i) identificação do comprador: nome completo, número do documento de identificação, endereço completo e telefone;
j) identificação do fornecedor: nome e endereço completo, nome do responsável pela dispensação e data do atendimento;
l) identificação da gráfica: nome, endereço e C.G.C impressos no rodapé de cada folha do talonário. Deverá constar também, a numeração inicial e final concedidas ao profissional ou instituição e o número da Autorização para confecção de talonários emitida pela Vigilância Sanitária local;
m) identificação do registro: anotação da quantidade aviada, no verso, e quando tratar-se de formulações magistrais, o número de registro da receita no livro de receituário.
§ 1º - A distribuição e controle do talão de Notificação de Receita "A" e a seqüência numérica da Notificação de Receita "B" (psicotrópicos) e a Notificação de Receita Especial (retinóides e talidomida), obedecerão ao disposto na Instrução Normativa deste Regulamento.
§ 2º - Em caso de emergência, poderá ser aviada a receita de medicamentos sujeitos a Notificação de Receita a base de substâncias constante das listas deste Regulamento e de suas atualizações, em papel não oficial, devendo conter obrigatoriamente: o diagnóstico ou CID, a justificativa do caráter emergencial do atendimento, data, inscrição no Conselho Regional e assinatura devidamente identificada. O estabelecimento que aviar a referida receita deverá anotar a identificação do comprador e apresentá-la à Autoridade Sanitária local dentro de 72 (setenta e duas) horas, para "visto".
Art 38 - Será suspenso o fornecimento do talonário da Notificação de Receita "A" (listas "A1" e "A2" - entorpecentes e "A3" - psicotrópicas) e/ou seqüência numérica da Notificação de Receita "B" (listas "B1" e "B2" -psicotrópicas) e da Notificação de Receita Especial (listas: "C2" - retinóicas de uso sistêmico e "C3" - imunossupressoras), quando for apurado seu uso indevido pelo profissional ou pela instituição, devendo o fato ser comunicado ao órgão de classe e as demais autoridades competentes.
Art 39 - As prescrições por cirurgiões dentistas e médicos veterinários só poderão ser feitas quando para uso odontológico e veterinário, respectivamente.
Art 40 - Nos casos de roubo, furto ou extravio de parte ou de todo o talonário da Notificação de Receita, fica obrigado o responsável a informar, imediatamente, à Autoridade Sanitária local, apresentando o respectivo Boletim de Ocorrência Policial (B.O.).
Art 41 - A Notificação de Receita "A", para a prescrição dos medicamentos e substâncias das listas "A1" e "A2" (entorpecentes) e "A3" (psicotrópicos), de cor amarela, será impressa, as expensas da Autoridade Sanitária Estadual ou do Distrito Federal, conforme modelo anexo IX, contendo 20 (vinte) folhas em cada talonário. Será fornecida gratuitamente pela Autoridade Sanitária competente do Estado, Município ou Distrito Federal, aos profissionais e instituições devidamente cadastrados.
§ 1º- Na solicitação do primeiro talonário de Notificação de Receita "A" o profissional ou o portador poderá dirigir-se, pessoalmente, ao Serviço de Vigilância Sanitária para o cadastramento ou encaminhar ficha cadastral devidamente preenchida com sua assinatura reconhecida em cartório.
§ 2º - Para o recebimento do talonário, o profissional ou o portador deverá estar munido do respectivo carimbo, que será aposto na presença da Autoridade Sanitária, em todas as folhas do talonário no campo "Identificação do Emitente".
Art 42 - A Notificação de Receita "A" será válida por 30 (trinta) dias a contar da data de sua emissão em todo o Território Nacional, sendo necessário que seja acompanhada da receita médica com justificativa do uso, quando para aquisição em outra Unidade Federativa.
Parágrafo único - As farmácias ou drogarias ficarão obrigadas a apresentar dentro do prazo de 72 (setenta e duas) horas, à Autoridade Sanitária local, as Notificações de Receita "A" procedentes de outras Unidades Federativas, para averiguação e visto.
Art 43 - As Notificações de Receitas "A" que contiverem medicamentos a base das substâncias constantes das listas "A1" e "A2" (entorpecentes) e "A3" (psicotrópicas) deste Regulamento e de suas atualizações deverão ser remetidas até o dia 15 (quinze) do mês subseqüente às Autoridades Sanitárias Estaduais ou Municipais e do Distrito Federal, através de relação em duplicata, que será recebida pela Autoridade Sanitária competente mediante recibo, as quais, após conferência, serão devolvidas no prazo de 30 (trinta) dias.
Art 44 - A Notificação de Receita "A" poderá conter no máximo de 5 (cinco) ampolas e para as demais formas farmacêuticas de apresentação, poderá conter a quantidade correspondente no máximo a 30 (trinta) dias de tratamento.
§ 1º - Acima das quantidades previstas neste Regulamento, o prescritor deverá apresentar, juntamente com a notificação, a justificativa em forma de CID ou diagnóstico e posologia, datando e assinando a mesma. A notificação receberá "visto prévio" da Autoridade Sanitária da localidade do prescritor, para ser aviada em estabelecimento farmacêutico.
§ 2º - No caso de formulações, as formas farmacêuticas deverão conter, no máximo, as concentrações que constam de Literaturas Nacional e Internacional oficialmente reconhecidas (ANEXO XIV).
Art 45 - Quando, por qualquer motivo, for interrompida a administração de medicamentos a base de substâncias constantes das listas deste Regulamento e de suas atualizações, a Autoridade Sanitária local deverá orientar o paciente ou seu responsável, sobre a destinação do medicamento remanescente.
Art 46 - A Notificação de Receita "B", de cor azul, impressa as expensas do profissional ou da instituição, conforme modelos anexos (X e XI) a este Regulamento, terá validade por um período de 30 (trinta) dias contados a partir de sua emissão e somente dentro da Unidade Federativa que concedeu a numeração.
Art 47 - A Notificação de Receita "B" poderá conter no máximo 5 (cinco) ampolas e, para as demais formas farmacêuticas, a quantidade para o tratamento correspondente no máximo a 60 (sessenta) dias.
§ 1º - Acima das quantidades previstas neste Regulamento, o prescritor deverá apresentar, juntamente com a notificação, a justificativa em forma de CID ou diagnóstico e posologia, datando e assinando a mesma. A notificação receberá "visto prévio" da Autoridade Sanitária da localidade do prescritor, para ser aviada em estabelecimento farmacêutico.
§ 2º - No caso de formulações, as formas farmacêuticas deverão conter, no máximo, as concentrações que constam de Literaturas Nacional e Internacional oficialmente reconhecidas (ANEXO XIV).
Art 48 - Ficam proibidas a prescrição e o aviamento de fórmulas contendo associação medicamentosa das substâncias anorexígenas constantes das listas deste Regulamento e de suas atualizações, quando associadas entre si ou com ansiolíticos, diuréticos, hormônios ou extratos hormonais e laxantes, bem como quaisquer outras substâncias com ação medicamentosa.
Art 49 - Ficam proibidas a prescrição e o aviamento de fórmulas contendo associação medicamentosa de substâncias ansiolíticas, constantes das listas deste Regulamento e de suas atualizações, associadas a substâncias simpatolíticas ou parassimpatolíticas.
Art 50 - A Notificação de Receita para prescrição do medicamento a base da substância da lista "C3" (imunossupressora), de cor branca, será impressa conforme modelo anexo (XIII), as expensas dos serviços públicos de saúde devidamente cadastrados junto ao órgão de Vigilância Sanitária Estadual.
§ 1º - A quantidade de Talidomida por prescrição, em cada Notificação de Receita, não poderá ser superior a necessária para o tratamento de 30 (trinta) dias.
§ 2º - A Notificação de Receita Especial da Talidomida, terá validade de 15 (quinze) dias, contados a partir de sua emissão e somente dentro da Unidade Federativa que concedeu a numeração.
Art 51 - A Notificação de Receita Especial, de cor branca, para prescrição de medicamentos a base de substâncias constantes da lista "C2" (retinóides de uso sistêmico) deste Regulamento e de suas atualizações será impressa às expensas do médico prescritor ou pela instituição a qual esteja filiado, terá validade por um período de 30 (trinta) dias contados a partir de sua emissão e somente dentro da Unidade Federativa que concedeu a numeração.
§ 1º - A Notificação de Receita Especial de Retinóides, para preparações farmacêuticas de uso sistêmico, poderá conter no máximo 5 (cinco) ampolas, e, para as demais formas farmacêuticas, a quantidade para o tratamento correspondente no máximo a 30 (trinta) dias, contados a partir de sua emissão e somente dentro da Unidade Federativa que concedeu a numeração.
§ 2º - A Notificação de Receita Especial para dispensação de medicamentos de uso sistêmico que contenham substâncias constantes da lista "C2" (retinóicas) deste Regulamento e de suas atualiza-ções, deverá estar acompanhada de "Termo de Consentimento Pós-Informação" (ANEXO XV e ANEXO XVI), fornecido pelos profissionais aos pacientes alertando-os que o medicamento é pessoal e intransferível, e das suas reações e restrições de uso.
Art 52 - Nos estabelecimentos hospitalares, clínicas médicas e clínicas veterinárias (no que couber), oficiais ou particulares, os medicamentos a base de substâncias constantes das listas "A1" e "A2" (entorpecentes), "A3", "B1" e "B2" (psicotrópicas), "C2" (retinóicas de uso sistêmico), "C3" (imunossupressoras), deste Regulamento e de suas atualizações, poderão ser dispensados ou aviados a pacientes internados ou em regime de semi-internato, mediante receita privativa do estabelecimento, subscrita por profissional em exercício no mesmo.
Parágrafo único - Para pacientes em tratamento ambulatorial será exigida a Notificação de Receita, obedecendo ao disposto no artigo 37 deste Regulamento.
DA RECEITA
Art 53 - O formulário da Receita de Controle Especial (ANEXO XVII), válido em todo o Território Nacional, deverá ser preenchido em 2 (duas) vias, manuscrito, datilografado ou informatizado, apresentando, obrigatoriamente, em destaque em cada uma das vias os dizeres: "1ª via - Retenção da Farmácia ou Drogaria" e "2ª via - Orientação ao Paciente".
§ 1º - A Receita de Controle Especial deverá estar escrita de forma legível, a quantidade em algarismos arábicos e por extenso, sem emenda ou rasura e terá validade de 30 (trinta) dias contados a partir da data de sua emissão para medicamentos a base de substâncias constantes das listas "C1" (outras substâncias sujeitas a controle especial), "C2" (retinóicas para uso tópico) e "C5" (anabolizantes) deste Regulamento e de suas atualizações.
§ 2º - A farmácia ou drogaria somente poderá aviar ou dispensar a receita, quando todos os itens estiverem devidamente preenchidos.
§ 3º - É vedada a aplicação do fator de correção em prescrições contendo formulações magistrais.
Art 54 - O aviamento ou dispensação de Receitas de Controle Especial, contendo medicamentos a base de substâncias constantes das listas "C1" (outras substâncias sujeitas a controle especial) e "C5" (anabolizantes) deste Regulamento e de suas atualizações, em qualquer forma farmacêutica ou apresentação, é privativo de farmácia ou drogaria e só poderá ser efetuado mediante receita, sendo a "1ª via - Retida no estabelecimento farmacêutico" e a "2ª via - Devolvida ao Paciente", com o carimbo comprovando o atendimento.
Art 55 - A prescrição de medicamentos a base de substâncias anti-retrovirais (lista "C4"), só poderá ser feita por médico e será aviada ou dispensada nas farmácias do Sistema Único de Saúde , em formulário próprio estabelecido pelo programa de DST/AIDS, onde a receita ficará retida. Ao paciente, deverá ser entregue um receituário médico com informações sobre seu tratamento. No caso do medicamento adquirido em farmácias ou drogarias será considerado o previsto no artigo anterior.
Parágrafo único - Fica vedada a prescrição de medicamentos a base de substâncias constantes da lista "C4" (anti-retrovirais) por médico veterinário ou cirurgiões dentistas.
Art 56 - As receitas que incluam medicamentos a base de substâncias constantes das listas "C1" (outras substâncias sujeitas a controle especial) , "C5" (anabolizantes) e os adendos das listas "A1" (entorpecentes), "A2" e "B1" (psicotrópicos) e "C2" (retinóicos para uso tópico) deste Regulamento e de suas atualizações, somente poderão ser aviadas quando prescritas por profissionais devidamente habilitados e com os campos descritos abaixo devidamente preenchidos:
a) identificação do emitente: impresso em formulário do profissional ou da instituição, contendo o nome e endereço do consultório e/ ou da residência do profissional, nº da inscrição no Conselho Regional e no caso da instituição, nome e endereço da mesma;
b) identificação do usuário: nome e endereço completo do paciente, e no caso de uso veterinário, nome e endereço completo do proprietário e identificação do animal;
c) nome do medicamento ou da substância prescrita sob a forma de Denominação Comum Brasileira (DCB), dosagem ou concentração, forma farmacêutica, quantidade (em algarismos arábicos e por extenso) e posologia;
d) data da emissão;
e) assinatura do prescritor: quando os dados do profissional estiverem devidamente impressos no cabeçalho da receita, este poderá apenas assiná-la. No caso de o profissional pertencer a uma instituição ou estabelecimento hospitalar, deverá identificar sua assinatura, manualmente de forma legível ou com carimbo, constando a inscrição no Conselho Regional;
f) identificação do registro: na receita retida, deverá ser anotado no verso, a quantidade aviada e, quando tratar-se de formulações magistrais, também o número do registro da receita no livro correspondente.
§ 1º - As prescrições por cirurgiões dentistas e médicos veterinários só poderão ser feitas quando para uso odontológico e veterinário, respectivamente.
§ 2º - Em caso de emergência, poderá ser aviada ou dispensada a receita de medicamento a base de substâncias constantes das listas "C1" (outras substâncias sujeitas a controle especial) deste Regulamento e de suas atualizações, em papel não privativo do profissional ou da instituição, contendo obrigatoriamente: o diagnóstico ou CID, a justificativa do caráter emergencial do atendimento, data, inscrição no Conselho Regional e assinatura devidamente identificada. O estabelecimento que aviar ou dispensar a referida receita deverá anotar a identificação do comprador e apresentá-la à Autoridade Sanitária do Estado, Município ou Distrito Federal, dentro de 72 (setenta e duas) horas, para visto.
Art 57 - Nos estabelecimentos hospitalares, clínicas médicas e clínicas veterinárias, oficiais ou particulares, os medicamentos a base de substâncias constantes das listas "C1" (outras substâncias sujeitas a controle especial) e "C5" (anabolizantes) deste Regulamento e de suas atualizações, poderão ser aviados ou dispensados a pacientes internados ou em regime de semi-internato, mediante receita privativa do estabelecimento, subscrita por profissional em exercício no mesmo.
Parágrafo único - Para pacientes em tratamento ambulatorial será exigida a Receita de Controle Especial em 2 (duas) vias, obedecendo ao disposto no artigo 56 deste Regulamento.
Art 58 - A prescrição poderá conter em cada receita, no máximo 3 (três) substâncias constantes da lista "C1" (outras substâncias sujeitas a controle especial) deste Regulamento e de suas atualizações, ou medicamentos que as contenham.
Art 59 - A prescrição de anti-retrovirais poderá conter em cada receita, no máximo 5 (cinco) substâncias constantes da lista "C4" (anti-retrovirais) deste Regulamento e de suas atualizações, ou medicamentos que as contenham.
Art 60 - A quantidade prescrita de cada substância constante da lista "C1" (outras substâncias sujeitas a controle especial) e "C5" (anabolizantes), deste Regulamento e de suas atualizações, ou medicamentos que as contenham, ficará limitada a 5 (cinco) ampolas e para as demais formas farmacêuticas, a quantidade para o tratamento correspondente a no máximo 60 (sessenta) dias.
Parágrafo único - No caso de prescrição de substâncias ou medicamentos antiparkinsonianos e anticonvulsivantes, a quantidade ficará limitada até 6 (seis) meses de tratamento.
Art 61 - Acima das quantidades previstas nos artigos 58 e 60, o prescritor deverá apresentar justificativa com o CID ou diagnóstico e posologia, datando e assinando as duas vias. A Receita de Controle Especial deverá ser encaminhada à Autoridade Sanitária local para visto prévio.
Art 62 - As substâncias de uso proscrito constantes da listas "E" (plantas que podem originar substâncias entorpecentes e/ou psicotrópicas) e "F" (substâncias de uso proscrito no Brasil) não poderão ser objeto de prescrição e manipulação de medicamentos alopáticos e homeopáticos.
CAPÍTULO VI
DA ESCRITURAÇÃO
Art 63 - Todo estabelecimento, entidade ou órgão oficial que produzir, comercializar, distribuir, beneficiar, preparar, fracionar, dispensar, utilizar, extrair, fabricar, transformar, embalar, reembalar, vender, comprar, armazenar ou manipular substância ou medicamento de que trata este Regulamento e de suas atualizações, com qualquer finalidade deverá escriturar e manter no estabelecimento para efeito de fiscalização e controle, livros de escrituração conforme a seguir discriminado:
§ 1º - Livro de Registro Específico (ANEXO XVIII) - para indústria farmoquímica, laboratórios farmacêuticos, distribuidoras, drogarias e farmácias.
§ 2º - Livro de Receituário Geral - para farmácias magistrais.
Art 64 - Os Livros de Receituário Geral e de Registro Específico deverão conter Termos de Abertura e de Encerramento (ANEXO XIX), lavrados pela Autoridade Sanitária do Estado, Município ou Distrito Federal.
§ 1º - Os livros a que se refere o caput deste artigo, poderão ser elaborados através de sistema informatizado previamente avaliado e aprovado pela Autoridade Sanitária do Estado, Município ou Distrito Federal.
§ 2º - No caso do Livro de Registro Específico, deverá ser mantido um livro para registro de substâncias e medicamentos entorpecentes (listas "A1" e "A2"), um livro para registro de substâncias e medicamentos psicotrópicos (listas "A3", "B1" e "B2"), um livro para as substâncias e medicamentos sujeitos a controle especial (listas "C1", "C2", "C4" e "C5") e um livro para a substância e/ou medicamento da lista "C3" (imunossupressoras).
§ 3º - Cada página do Livro de Registro Específico destina-se a escrituração de uma só substância ou medicamento, devendo ser efetuado o registro através da denominação genérica (DCB), combinado com o nome comercial.
Art 65 - Os Livros, Balanços e demais documentos comprovantes de movimentação de estoque, deverão ser arquivados no estabelecimento pelo prazo de 2 (dois) anos, findo o qual poderão ser destruídos.
§ 1º - A escrituração de todas as operações relacionadas com substâncias constantes nas listas deste Regulamento e de suas atualizações, bem como os medicamentos que as contenham, será feita de modo legível e sem rasuras ou emendas, devendo ser atualizada semanalmente.
§ 2º - O Livro de Registro Específico das substâncias constantes da lista "C3" (imunossupressoras) e do medicamento Talidomida, bem como os demais documentos comprovantes da movimentação de estoque deverão ser mantidos no estabelecimento pelo prazo de 5 (cinco) anos.
§ 3º - Os órgãos oficiais credenciados junto a Autoridade Sanitária competente, para dispensar o medicamento Talidomida deverão possuir um Livro de Registro de Notificação de Receita, contendo a data de dispensação, o nome, idade e sexo do paciente, o CID, quantidade de comprimidos, o nome e CRM do Médico e o nome do técnico responsável pela dispensação. Este Livro deverá permanecer na unidade por um período de 10 (dez) anos.
Art 66 - Os Livros de Registros Específicos destinam-se a anotação, em ordem cronológica, de estoque, entradas (por aquisição ou produção), saídas (por vendas, processamento, beneficiamento, uso) e perdas.
Art 67 - Quando, por motivo de natureza fiscal ou processual, o Livro de Registro Específico for apreendido pela Autoridade Sanitária ou Policial, ficarão suspensas todas as atividades relacionadas a substâncias e/ou medicamentos nele registrados até que o referido livro seja liberado ou substituído.
CAPÍTULO VII
DA GUARDA
Art 68 - As substâncias constantes das listas deste Regulamento de suas atualizações, bem como os medicamentos que as contenham, existentes nos estabelecimentos, deverão ser obrigatoriamente guardados sob chave ou outro dispositivo que ofereça segurança, em local exclusivo para este fim, sob a responsabilidade do farmacêutico ou químico responsável, quando se tratar de indústria farmoquímica.
CAPITULO VIII
DOS BALANÇOS
Art 69 - O Balanço de Substâncias Psicoativas e Outras Substâncias Sujeitas a Controle Especial - BSPO (ANEXO XX), será preenchido com a movimentação do estoque das substâncias constantes das listas "A1" e "A2" (entorpecentes), "A3","B1" e "B2" (psicotrópicas), "C1"(outras substâncias sujeitas a controle especial), "C2" (retinóicas), "C3" (imunossupressoras), "C4" (anti-retrovirais) e "C5" (anabolizantes), deste Regulamento e de suas atualizações, em 3 (três) vias, e remetido à Autoridade Sanitária pelo farmacêutico/químico responsável trimestralmente até o dia 15 (quinze) dos meses de abril, julho, outubro e janeiro.
§ 1º - O Balanço Anual deverá ser entregue até o dia 31 (trinta e um) de janeiro do ano seguinte.
§ 2º - Após o visto da Autoridade Sanitária, o destino das vias será:
§ 3º - As 1ª e 2ª vias deverão ser acompanhadas dos respectivos disquetes quando informatizado.
§ 4º - O Balanço de Substâncias Psicoativas e Outras Substâncias Sujeitas a Controle Especial - BSPO, deverá ser a cópia fiel e exata da movimentação das substâncias constantes das listas deste Regulamento e de suas atualizações, registrada nos Livros a que se refere o Capítulo VI deste Regulamento.
§ 5º - É vedado a utilização de ajustes, utilizando o fator de correção, de substâncias constantes das listas deste Regulamento e de suas atualizações, quando do preenchimento do BSPO.
§ 6º - A aplicação de ajustes de substâncias constantes das listas deste Regulamento e de suas atualizações, que compõem os dados do BSPO será privativa da Autoridade Sanitária competente do Ministério da Saúde.
Art 70 - O Balanço de Medicamentos Psicoativos e de outros Sujeitos a Controle Especial - BMPO, destina-se ao registro de vendas de medicamentos a base de substâncias constantes das listas "A1", "A2" (entorpecentes), "A3" e "B2" (psicotrópicos) e "C4" (anti-retrovirais) deste Regulamento e de suas atualizações, por farmácias e drogarias conforme modelo (ANEXO XXI) , em 2 (duas) vias, e remetido à Autoridade Sanitária pelo Farmacêutico Responsável trimestralmente até o dia 15 (quinze) dos meses de abril, julho, outubro e janeiro.
1ª via - retida pela Autoridade Sanitária.
2ª via - retida pela farmácia ou drogaria.
§ 3º - As farmácias de unidades hospitalares, clínicas médicas e veterinárias, ficam dispensadas da apresentação do Balanço de Medicamentos Psicoativos e de outros Sujeitos a Controle Especial (BMPO).
Art 71 - O Mapa do Consolidado das Prescrições de Medicamentos - MCPM (ANEXO XXII), destina-se ao registro das prescrições de medicamentos a base de substâncias constantes das listas "C3" (imunossupressoras) deste Regulamento e de suas atualizações, pelos órgãos oficiais autorizados, em 3 (três) vias, e remetido à Autoridade Sanitária pelo Farmacêutico Responsável trimestralmente até o dia 15 (quinze) dos meses de abril, julho, outubro e janeiro de cada ano
§ 1º - Após o carimbo da Autoridade Sanitária, o destino das vias será:
§ 2º - O MCPM do medicamento Talidomida será apresentado à Autoridade Sanitária, pelas farmácias privativas das unidades públicas que dispensem o referido medicamento para os pacientes cadastrados nos Programas Governamentais específicos.
Art 72 - A Relação Mensal de Venda de Medicamentos Sujeitos a Controle Especial - RMV (ANEXO XXIII), destina-se ao registro das vendas de medicamentos a base de substâncias constantes das listas deste Regulamento e de suas atualizações, excetuando-se as substâncias constantes da lista "D1" (precursoras), efetuadas no mês anterior, por indústria ou laboratório farmacêutico e distribuidor, e serão encaminhadas à Autoridade Sanitária, pelo Farmacêutico Responsável , até o dia 15 (quinze) de cada mês, em 2 (duas) vias, sendo uma das vias retida pela Autoridade Sanitária e a outra devolvida ao estabelecimento depois de visada.
Art 73 - A Relação Mensal de Notificações de Receita "A" - RMNRA (ANEXO XXIV), destina-se ao registro das Notificações de Receita "A" retidas em farmácias e drogarias quando da dispensação de medicamentos a base de substâncias constantes das listas "A1" e "A2" (entorpecentes) e "A3" (psicotrópicas) deste Regulamento e de suas atualizações, a qual será encaminhada junto com as respectivas notificações à Autoridade Sanitária, pelo farmacêutico responsável , até o dia 15 (quinze) de cada mês, em 2 (duas) vias, sendo uma das vias retida pela Autoridade Sanitária e a outra devolvida ao estabelecimento depois de visada.
Parágrafo único - A devolução das notificações de receitas a que se refere o caput deste artigo se dará no prazo de 30 (trinta) dias a contar da data de entrega.
Art 74 - A falta de remessa da documentação mencionada nos artigos 69, 70, 71, 72 e 73, nos prazos estipulados por este Regulamento, sujeitará o infrator as penalidades previstas na legislação sanitária em vigor.
Art 75 - A Secretaria de Vigilância Sanitária do Ministério da Saúde e o Órgão de Repressão a Entorpecentes da Polícia Federal, trocarão, anualmente, relatórios sobre as informações dos Balanços envolvendo substâncias e medicamentos entorpecentes, psicotrópicos e precursoras.
Art 76 - A Secretaria de Vigilância Sanitária do Ministério da Saúde encaminhará relatórios estatísticos, trimestral e anualmente ao órgão Internacional de Fiscalização de Drogas das Nações Unidas com a movimentação relativas as substâncias entorpecentes, psicotrópicos e precursoras.
Parágrafo único - Os prazos para o envio dos relatórios estatísticos de que trata o caput desse artigo obedecerão aqueles previstos nas Convenções Internacionais de Entorpecentes, Psicotrópicos e Precursoras.
Art 77 - É permitido o preenchimento dos dados em formulários ou por sistema informatizado, da documentação a que se refere este Regulamento, providenciando a remessa do disquete à Autoridade Sanitária do Ministério da Saúde, obedecendo aos modelos e prazos estipulados neste capítulo.
CAPÍTULO IX
DA EMBALAGEM
Art 78 - É atribuição da Secretaria de Vigilância Sanitária do Ministério da Saúde a padronização de bulas, rótulos e embalagens dos medicamentos que contenham substâncias constantes das listas deste Regulamento e suas atualizações.
Art 79 - Os medicamentos a base de substâncias constantes das listas deste Regulamento e de suas atualizações deverão ser comercializados em embalagens invioláveis e de fácil identificação.
Art 80 - É vedado às drogarias o fracionamento da embalagem original de medicamentos a base de substâncias constantes das listas deste Regulamento.
Art 81 - Os rótulos de embalagens de medicamentos a base de substâncias constantes das listas "A1"e "A2" (entorpecentes) e "A3" (psicotrópicos), deverão ter uma faixa horizontal de cor preta abrangendo todos os lados, na altura do terço médio e com largura não inferior a um terço da largura do maior lado da face maior, contendo os dizeres: "Venda sob Prescrição Médica" - "Atenção: Pode Causar Dependência Física ou Psíquica".
Parágrafo único - Nas bulas dos medicamentos a que se refere o caput deste artigo deverá constar obrigatoriamente, em destaque e em letras de corpo maior de que o texto, a expressão: "Atenção: Pode Causar Dependência Física ou Psíquica".
Art 82 - Os rótulos de embalagens de medicamentos a base de substâncias constantes das listas "B1" e "B2" (psicotrópicos), deverão ter uma faixa horizontal de cor preta abrangendo todos seus lados, na altura do terço médio e com largura não inferior a um terço da largura do maior lado da face maior, contendo os dizeres: "Venda sob Prescrição Médica" - "O Abuso deste Medicamento pode causar Dependência".
Parágrafo único - Nas bulas dos medicamentos a que se refere o caput deste artigo, deverá constar, obrigatoriamente, em destaque e em letras de corpo maior de que o texto, a expressão: "O Abuso deste Medicamento pode causar Dependência".
Art 83 - Nos casos dos medicamentos contendo a substância Anfepramona (lista "B2", psicotrópicos-anorexígenos) deverá constar, em destaque, no rótulo e bula, a frase: "Atenção: Este Medicamento pode causar Hipertensão Pulmonar".
Art 84 - Os rótulos de embalagens dos medicamentos a base de substâncias constantes das listas "C1" (outras substâncias sujeitas a controle especial), "C2" (retinóides de uso tópico), "C4" (anti-retrovirais) e "C5" (anabolizantes) deste Regulamento e de suas atualizações, deverão ter uma faixa horizontal de cor vermelha abrangendo todos os seus lados, na altura do terço médio e com largura não inferior a um terço da largura do maior lado da face maior, contendo os dizeres: "Venda Sob Prescrição Médica"- "Só Pode ser Vendido com Retenção da Receita".
§ 1º - Nas bulas e rótulos dos medicamentos a que se refere o caput deste artigo, deverá constar, obrigatoriamente, em destaque e em letras de corpo maior de que o texto, a expressão: "Venda Sob Prescrição Médica"- "Só Pode ser Vendido com Retenção da Receita".
§ 2º - Nas bulas e rótulos dos medicamentos que contêm substâncias anti-retrovirais, constantes da lista "C4" deste Regulamento e de suas atualizações, deverá constar, obrigatoriamente, em destaque e em letras de corpo maior de que o texto, a expressão: "Venda Sob Prescrição Médica" - "Atenção - O Uso Incorreto Causa Resistência do Vírus da AIDS e Falha no Tratamento".
§ 3º - Nas bulas e rótulos dos medicamentos de uso tópico, manipulados ou fabricados, que contêm substâncias retinóicas, constantes da lista "C2" deste Regulamento e de suas atualizações, deverá constar, obrigatoriamente, em destaque e em letras de corpo maior de que o texto, a expressão: "Venda Sob Prescrição Médica" - "Atenção - Não Use este Medicamento sem Consultar o seu Médico, caso esteja Grávida. Ele pode causar Problemas ao Feto".
Art 85 - Os rótulos de embalagens dos medicamentos de uso sistêmico, a base de substâncias constantes das listas "C2" (retinóicas) deste Regulamento e suas atualizações, deverão ter uma faixa horizontal de cor vermelha abrangendo todos os seus lados, na altura do terço médio e com largura não inferior a um terço da largura do maior lado da face maior, contendo os dizeres "Venda Sob Prescrição Médica" - "Atenção: Risco para Mulheres Grávidas, Causa Graves Defeitos na Face, nas Orelhas, no Coração e no Sistema Nervoso do Feto".
Parágrafo único - Nas bulas dos medicamentos a que se refere o caput deste artigo, deverá constar, obrigatoriamente, em destaque e em letras de corpo maior de que o texto, a expressão: "Venda Sob Prescrição Médica" - "Atenção: Risco para Mulheres Grávidas, Causa Graves Defeitos na Face, nas Orelhas, no Coração e no Sistema Nervoso do Feto".
Art 86 - Os rótulos das embalagens dos medicamentos contendo as substâncias da lista "C3" (imunossupressoras) e do medicamento Talidomida seguirão o modelo estabelecido em legislação sanitária em vigor.
Art 87 - As formulações magistrais contendo substâncias constantes das listas deste Regulamento e de suas atualizações deverão conter no rótulo os dizeres equivalentes aos das embalagens comerciais dos respectivos medicamentos.
CAPÍTULO X
DO CONTROLE E FISCALIZAÇÃO
Art 88 - As Autoridades Sanitárias do Ministério da Saúde, Estados, Municípios e Distrito Federal inspecionarão periodicamente as empresas ou estabelecimentos que exerçam quaisquer atividades relacionadas as substâncias e medicamentos de que trata este Regulamento e suas atualizações, para averiguar o cumprimento dos dispositivos legais.
Parágrafo único - O controle e a fiscalização da produção, comércio, manipulação ou uso das substâncias e medicamentos de que trata esta Regulamento e suas atualizações serão executadas, quando necessário, em conjunto com o órgão competente do Ministério da Fazenda, Ministério da Justiça e seus congêneres nos Estados, Municípios e Distrito Federal.
Art 89 - As empresas, estabelecimentos, instituições ou entidades que exerçam atividades correlacionadas com substâncias constantes das listas deste Regulamento e suas atualizações ou seus respectivos medicamentos, quando solicitadas pelas Autoridades Sanitárias competentes, deverão prestar as informações ou proceder a entrega de documentos, nos prazos fixados, a fim de não obstarem a ação de vigilância sanitária e correspondentes medidas que se fizerem necessárias.
CAPÍTULO XI
DAS DISPOSIÇÕES FINAIS
Art 90 - É proibido distribuir amostras grátis de substâncias e/ou medicamentos constantes deste Regulamento e de suas atualizações.
§ 1º - Será permitida a distribuição de amostras grátis de medicamentos que contenham substâncias constantes das listas "C1" (outras substâncias sujeitas a controle especial) e "C4" (anti-retrovirais) deste Regulamento e de suas atualizações, em suas embalagens originais, exclusivamente aos profissionais médicos, que assinarão o comprovante de distribuição emitido pelo fabricante.
§ 2º - Em caso de o profissional doar medicamentos amostras-grátis à instituição a que pertence, deverá fornecer o respectivo comprovante de distribuição devidamente assinado. A instituição deverá dar entrada em Livro de Registro da quantidade recebida.
§ 3º - O comprovante a que se refere o caput deste artigo, deverá ser retido pelo fabricante ou pela instituição que recebeu a amostra-grátis do médico, pelo período de 2 (dois) anos, ficando a disposição da Autoridade Sanitária para fins de fiscalização.
§ 4º - É vedada a distribuição de amostras-grátis de medicamentos a base de Misoprostol.
Art 91 - A propaganda de substâncias e medicamentos, constantes das listas deste Regulamento e suas atualizações, somente poderá ser efetuada em revista ou publicação técno-científica de circulação restrita a profissionais de saúde.
§ 1º - A propaganda referida no caput deste artigo deverá obedecer aos dizeres que foram aprovados no registro do medicamento, não podendo conter figuras, desenhos, ou qualquer indicação que possa induzir a conduta enganosa ou causar interpretação falsa ou confusa quanto a origem, procedência, composição ou qualidade, que atribuam ao medicamento finalidades ou características diferentes daquelas que realmente possua.
§ 2º - A propaganda de formulações será permitida somente acompanhada de embasamento técno-científico apoiado em literatura Nacional ou Internacional oficialmente reconhecidas.
Art 92 - Somente as farmácias poderão receber receitas de medicamentos magistrais ou oficinais para aviamento, vedada a intermediação sob qualquer natureza.
Art 93 - As indústrias veterinárias e distribuidoras, deverão atender as exigências contidas neste Regulamento que refere-se a Autorização Especial, ao comercio internacional e nacional e registro em livros específicos.
Art 94 - Os medicamentos destinados a uso veterinário, serão regulamentados em legislação específica.
Art 95 - Os profissionais, serviços médicos e/ou ambulatoriais poderão possuir, na maleta de emergência, até 3 (três) ampolas de medicamentos entorpecentes e até 5 (cinco) ampolas de medicamentos psicotrópicos, para aplicação em caso de emergência, ficando sob sua guarda e responsabilidade.
Parágrafo único - A reposição das ampolas se fará com a Notificação de Receita devidamente preenchida com o nome e endereço completo do paciente ao qual tenha sido administrado o medicamento.
Art 96 - Quando houver apreensão policial, de plantas, substâncias e/ou medicamentos, de uso proscrito no Brasil - Lista - "E" (plantas que podem originar substâncias entorpecentes e/ou psicotrópicas) e lista "F" (substâncias proscritas), a guarda dos mesmos será de responsabilidade da Autoridade Policial competente, que solicitará a incineração à Autoridade Judiciária.
§ 1º - Se houver determinação do judicial, uma amostra deverá ser resguardada, para efeito de análise de contra perícia.
§ 2º - A Autoridade Policial, em conjunto com a Autoridade Sanitária providenciará a incineração da quantidade restante, mediante autorização expressa do judicial. As Autoridades Sanitárias e Policiais lavrarão o termo e auto de incineração, remetendo uma via à autoridade judicial para instrução do processo.
Art 97 - Quando houver apreensão policial, de substâncias das listas constantes deste Regulamento e de suas atualizações, bem como os medicamentos que as contenham, dentro do prazo de validade, a sua guarda ficará sob a responsabilidade da Autoridade Policial competente. O juiz determinará a destinação das substâncias ou medicamentos apreendidos.
Art 98 - A Autoridade Sanitária local regulamentará, os procedimentos e rotinas em cada esfera de governo, bem como cumprirá e fará cumprir as determinações constantes deste Regulamento.
Art 99 - O não cumprimento das exigências deste Regulamento, constituirá infração sanitária, ficando o infrator sujeito as penalidades previstas na legislação sanitária vigente, sem prejuízo das demais sanções de natureza civil ou penal cabíveis.
Art 100 - Os casos omissos serão submetidos à apreciação da Autoridade Sanitária competente do Ministério da Saúde, Estados, Municípios e Distrito Federal.
Art 101 - As Autoridades Sanitárias e Policiais auxiliar-se-ão mutuamente nas diligências que se fizerem necessárias ao fiel cumprimento deste Regulamento.
Art 102 - As listas de substâncias constantes deste Regulamento serão atualizadas através de publicações em Diário Oficial da União sempre que ocorrer concessão de registro de produtos novos, alteração de fórmulas, cancelamento de registro de produto e alteração de classificação de lista para registro anteriormente publicado.
Art 103 - Somente poderá manipular ou fabricar substâncias constantes das listas deste Regulamento e de suas atualizações bem como os medicamentos que as contenhamos, os estabelecimentos sujeitos a este Regulamento, quando atendidas as Boas Práticas de Manipulação e Controle (BPM e C) e Boas Práticas de Fabricação e Controle (BPF e C), respectivamente para farmácias e indústrias.
Art 104 - As empresas importadoras, qualquer que seja a natureza ou a etapa de processamento do medicamento importado a base de substancias constantes das listas deste Regulamento e de suas atualizações, deverão comprovar, perante a SVS/MS, no momento da entrada da mercadoria no país, o cumprimento das Boas Práticas de Fabricação e Controle (BPF e C) pelas respectivas unidades fabris de origem, mediante a apresentação do competente Certificado, emitido a menos de 2 (dois) anos, pela Autoridade Sanitária do país de procedência ou de Secretaria de Vigilância Sanitária do Ministério da Saúde.
Art 105 - A revisão e atualização deste Regulamento Técnico deverão ocorrer no prazo de 2 (dois) anos.
Art 106 - As empresas e estabelecimentos abrangidos por este Regulamento terão um prazo de 90 (noventa) dias a contar da data de sua publicação para se adequarem ao mesmo.
Art 107 - O Órgão de Vigilância Sanitária do Ministério da Saúde baixará instruções normativas de caráter geral ou específico sobre a aplicação do presente Regulamento, bem como estabelecerá documentação, formulários e periodicidades de informações.
Art 108 - Compete aos Estados, Municípios e o Distrito Federal, exercer a fiscalização e o controle dos atos relacionados a produção, comercialização e uso de substâncias constantes das listas deste Regulamento e de suas atualizações, bem como os medicamentos que as contenham, no âmbito de seus territórios bem como fará cumprir as determinações da legislação federal pertinente e deste Regulamento.
Art 109 - Ficam revogadas as Portarias nº 54/74, nº 12/80, nº 15/81, nº 02/85, nº 01/86, nº 27/86-DIMED, nº 28/86-DIMED, nº 11/88, nº 08/89, nº 17/91, nº 59/91, nº 61/91, nº 101/91, nº 59/92, nº 66/93, nº 81/93, nº 98/93, nº 101/93, nº 87/94, nº 21/95, nº 82/95, nº 97/95, nº 110/95, nº 118/96, nº 120/96, nº 122/96, nº 132/96, nº 151/96, nº 189/96, nº 91/97, nº 97/97, nº 103/97, e nº 124/97, além dos artigos 2º, 3º, 4º, 13, 14, 15, 18, 19, 21, 22, 23, 24, 28, 26, 27 31, 35 e 36 da Portaria nº 354 de 15/08/97.
Art 110 - Este Regulamento entrará em vigor na data da publicação, revogando as disposições em contrário.
Marta Nobrega Martinez
ANEXO I
LISTA - A1
LISTA DAS SUBSTÂNCIAS
ENTORPECENTES
(Sujeitas a Notificação de Receita "A")
ADENDO:
1) Ficam também sob controle, todos os sais, isômeros e intermediários das substâncias enumeradas acima.
2) Preparações a base de DIFENOXILATO, contendo por unidade posológica, não mais que 2,5 miligramas de DIFENOXILATO calculado como base, e uma quantidade de Sulfato de Atropina equivalente a, pelo menos, 1,0% da quantidade de DIFENOXILATO, ficam sujeitas a prescrição da Receita de Controle Especial, em 2 (duas) vias e os dizeres de rotulagem e bula deverão apresentar a seguinte frase: "VENDA SOB PRESCRIÇÃO MÉDICA - SÓ PODE SER VENDIDO COM RETENÇÃO DA RECEITA ".
LISTA - A2
LISTA DAS SUBSTÂNCIAS ENTORPECENTES DE USO PERMITIDO SOMENTE EM CONCENTRAÇÕES ESPECIAIS
(Sujeitas a Notificação de Receita "A")
ADENDO:
1) Ficam também sob controle, todos os sais, isômeros e intermediários das substâncias enumeradas acima.
2) Preparações de ACETILDIIDROCODEÍNA, CODEÍNA, DIIDROCODEÍNA, ETILMORFINA, FOLCODINA, NICODICODINA, NORCODEÍNA e TRAMADOL associadas a um ou mais outros componentes, em que a quantidade de entorpecentes não exceda 100 miligramas por unidade posológica, e em que a concentração não ultrapasse a 2,5% nas preparações de formas indivisíveis ficam sujeitas prescrição da Receita de Controle Especial, em 2 (duas) vias e os dizeres de rotulagem e bula deverão apresentar a seguinte frase: "VENDA SOB PRESCRIÇÃO MÉDICA - SÓ PODE SER VENDIDO COM RETENÇÃO DA RECEITA ".
3) Associações medicamentosas contendo DEXTROPROPOXIFENO sob a forma de comprimidos sem outra substância listada nesta Regulamento, em que a quantidade de entorpecente não exceda 100 miligramas por unidade posológica e em que a concentração não ultrapasse 2,5% nas preparações indivisíveis, ficam sujeitas a prescrição da Receita de Controle Especial, em 2 (duas) vias e os dizeres de rotulagem e bula deverão apresentar a seguinte frase: "VENDA SOB PRESCRIÇÃO MÉDICA - SÓ PODE SER VENDIDO COM RETENÇÃO DA RECEITA ".
4) Preparações a base de PROPIRAM, contendo não mais que 100 miligramas de PROPIRAM por unidade posológica e associados, no mínimo, a igual quantidade de metilcelulose, ficam sujeitas a prescrição da Receita de Controle Especial, em 2 (duas) vias e os dizeres de rotulagem e bula deverão apresentar a seguinte frase: "VENDA SOB PRESCRIÇÃO MÉDICA - SÓ PODE SER VENDIDO COM RETENÇÃO DA RECEITA ".
LISTA - A3
LISTA DAS SUBSTÂNCIAS PSICOTRÓPICAS
(Sujeita a Notificação de Receita "A")
ADENDO:
1) Ficam também sob controle, todos os sais, isômeros e intermediários das substâncias enumeradas acima.
LISTA - B1
LISTA DAS SUBSTÂNCIAS PSICOTRÓPICAS
(Sujeitas a Notificação de Receita "B")
ADENDO:
1) Ficam também sob controle, todos os sais, isômeros e intermediários das substâncias enumeradas acima.
2) Os medicamentos que contenham FENOBARBITAL, PROMINAL, BARBITAL e BARBEXACLONA, ficam sujeitos a prescrição da Receita de Controle Especial, em 2 (duas) vias e os dizeres de rotulagem e bula deverão apresentar a seguinte frase: "VENDA SOB PRESCRIÇÃO MÉDICA - SÓ PODE SER VENDIDO COM RETENÇÃO DA RECEITA".
LISTA - B2
LISTA DAS SUBSTÂNCIAS PSICOTRÓPICAS ANOREXÍGENAS
(Sujeitas a Notificação de Receita "B")
ADENDO:
1) Ficam também sob controle, todos os sais, isômeros e intermediários das substâncias enumeradas acima.
LISTA - C1
LISTA DAS OUTRAS SUBSTÂNCIAS SUJEITAS A CONTROLE ESPECIAL
(Sujeitas a Receita de Controle Especial em duas vias)
ADENDO:
1) Ficam também sob controle, todos os sais, isômeros e intermediários das substâncias enumeradas acima.
2) Ficam suspensas, temporariamente, as atividades mencionadas no artigo 2º deste Regulamento, relacionadas as substâncias FENFLURAMINA E DEXFENFLURAMINA e seus sais, bem como os medicamentos que as contenham, até que os trabalhos de pesquisa em desenvolvimento no país e no exterior, sobre efeitos colaterais indesejáveis, sejam ultimados.
3) Os medicamentos a base da substância LOPERAMIDA ficarão sujeitos a venda sob prescrição médica sem a retenção de receita.
4) Só será permitida a compra e uso do medicamento contendo a substância MISOPROSTOL em estabelecimentos hospitalares devidamente cadastrados junto a Vigilância Sanitária para este fim.
5) Os medicamentos a base da substância FENILPROPANOLAMINA, ficarão sujeitos a venda sob prescrição médica sem a retenção de receita.
LISTA - C2
LISTA DE SUBSTÂNCIAS RETINÓICAS
(Sujeitas a Notificação de Receita Especial)
ADENDO:
1) Ficam também sob controle, todos os sais, isômeros e intermediários das substâncias enumeradas acima.
2) Os medicamentos de uso tópico contendo as substâncias desta lista ficarão sujeitos a prescrição de Receita de Controle Especial em 2 (duas) vias.
LISTA - C3
LISTA DE SUBSTÂNCIAS IMUNOSSUPRESSORAS
(Sujeita a Notificação de Receita Especial)
1) FTALIMIDOGLUTARIMIDA (TALIDOMIDA)
ADENDO:
1) Ficam também sob controle, todos os sais, isômeros e intermediários das substâncias enumeradas acima.
LISTA - C4
LISTA DAS SUBSTÂNCIAS ANTI-RETROVIRAIS
(Sujeitas a Receituário do Programa da DST/AIDS ou Receita de Controle Especial)
ADENDO:
1) Ficam também sob controle, todos os sais, isômeros e intermediários das substâncias enumeradas acima.
2) Os medicamentos a base de substâncias anti-retrovirais constantes deste Regulamento, deverão ser prescritos em receituário próprio estabelecido pelo Programa de DST/AIDS do Ministério da Saúde, para dispensação nas farmácias hospitalares/ambulatoriais do Sistema Público de Saúde.
3) Os medicamentos a base de substâncias anti-retrovirais constantes deste Regulamento, quando dispensados em farmácias e drogarias, ficarão sujeitos a venda sob Receita de Controle Especial em 2 (duas) vias.
LISTA - C5
LISTA DAS SUBSTÂNCIAS ANABOLIZANTES
(Sujeita a Receita de Controle Especial)
ADENDO:
1) Ficam também sob controle, todos os sais, isômeros e intermediários das substâncias enumeradas acima;
LISTA - D1
LISTA DE SUBSTÂNCIAS PRECURSORAS DE ENTORPECENTES E/OU PSICOTRÓPICOS
(Sujeitas a Receita Médica sem Retenção)
ADENDO:
1) Ficam também sob controle, todos os sais, isômeros e intermediários das substâncias enumeradas acima.
LISTA - D2
LISTA DE INSUMOS QUÍMICOS UTILIZADOS COMO PRECURSORES PARA FABRICAÇÃO E SÍNTESE DE
ENTORPECENTES E/OU PSICOTRÓPICOS
(Sujeitos a Controle do Ministério da Justiça)
ADENDO:
1) Produtos e insumos químicos, sujeitos a controle da Polícia Federal, de acordo com a Lei nº 9.017 de 30/03/1995, Decreto nº 1.646 de 26/09/1995, Decreto nº 2.036 de 14/10/1996, Resolução nº 01/95 de 07 de novembro de 1995 e Instrução Normativa nº 06 de 25/09/1997.
2) O insumo químico ou substância CLOROFÓRMIO está proibido para uso em medicamentos.
LISTA - E
LISTA DE PLANTAS QUE PODEM ORIGINAR SUBSTÂNCIAS ENTORPECENTES E/OU PSICOTRÓPICAS
ADENDO:
1) Ficam também sob controle, todos os sais, isômeros e intermediários das substâncias enumeradas acima.
LISTA - F
LISTA DAS SUBSTÂNCIAS DE USO PROSCRITO NO BRASIL
ADENDO:
1) Ficam também sob controle, todos os sais, isômeros e intermediários das substâncias enumeradas acima.




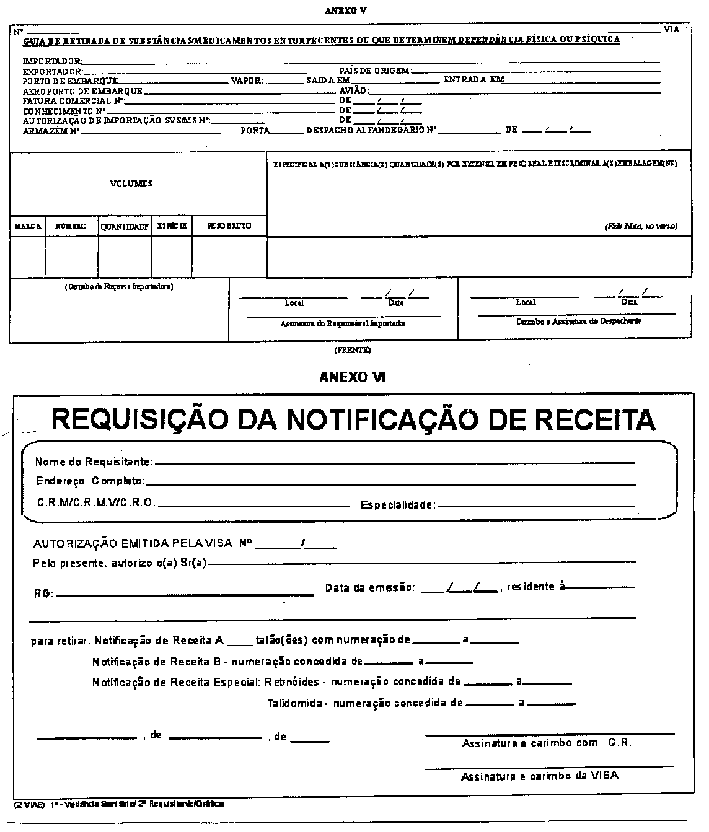
ANEXO X
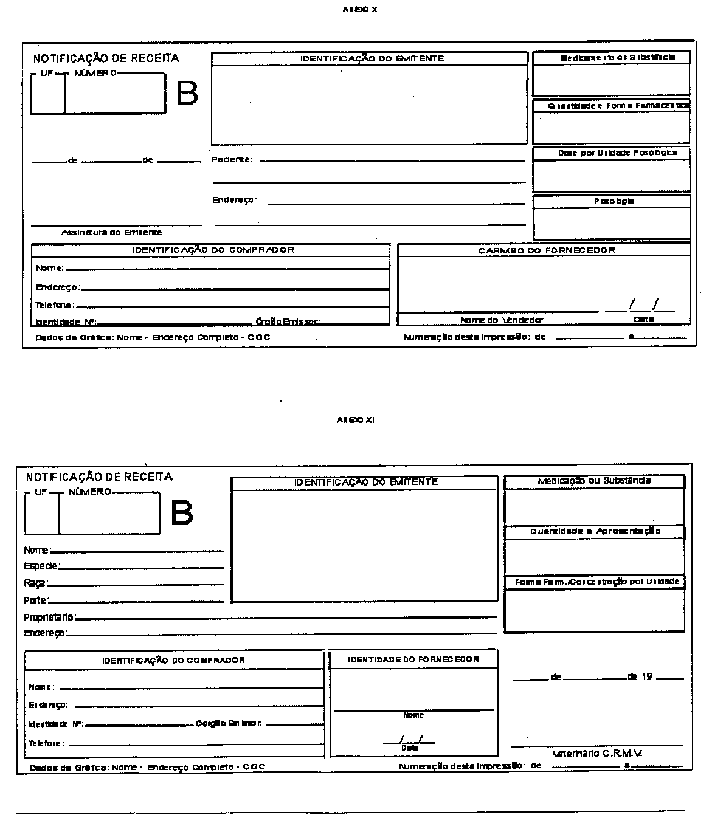
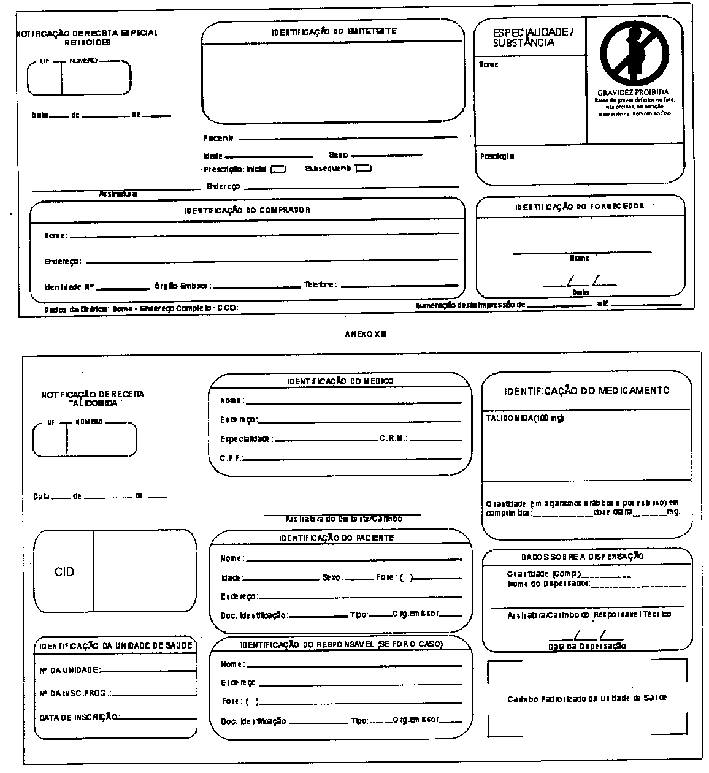



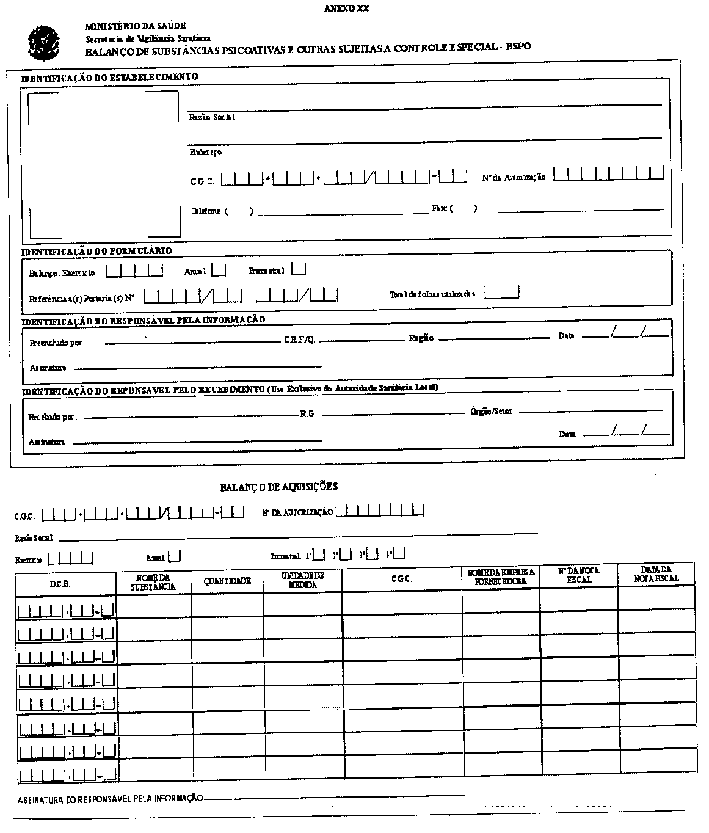
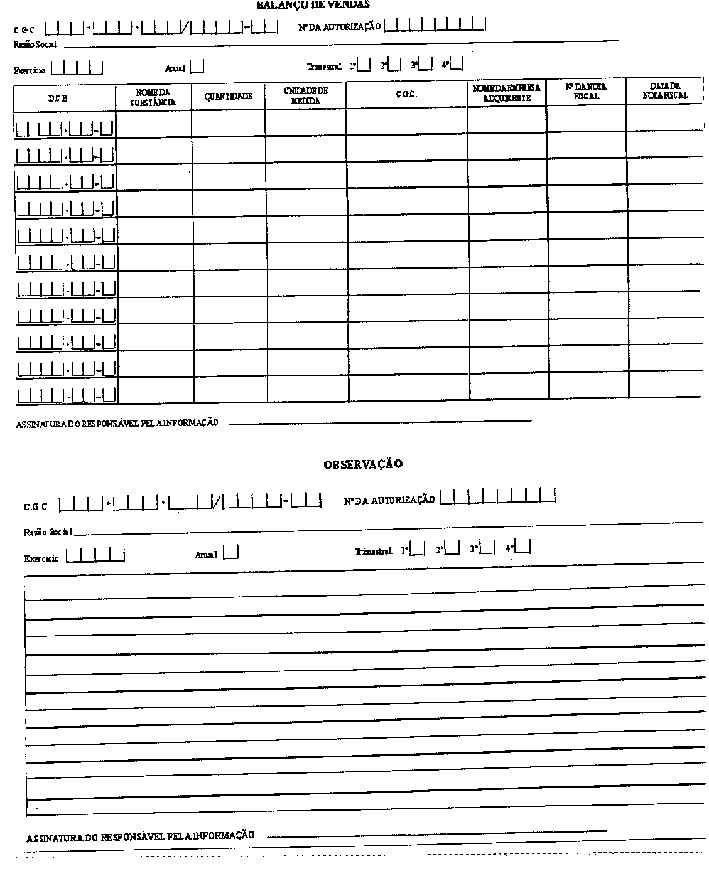

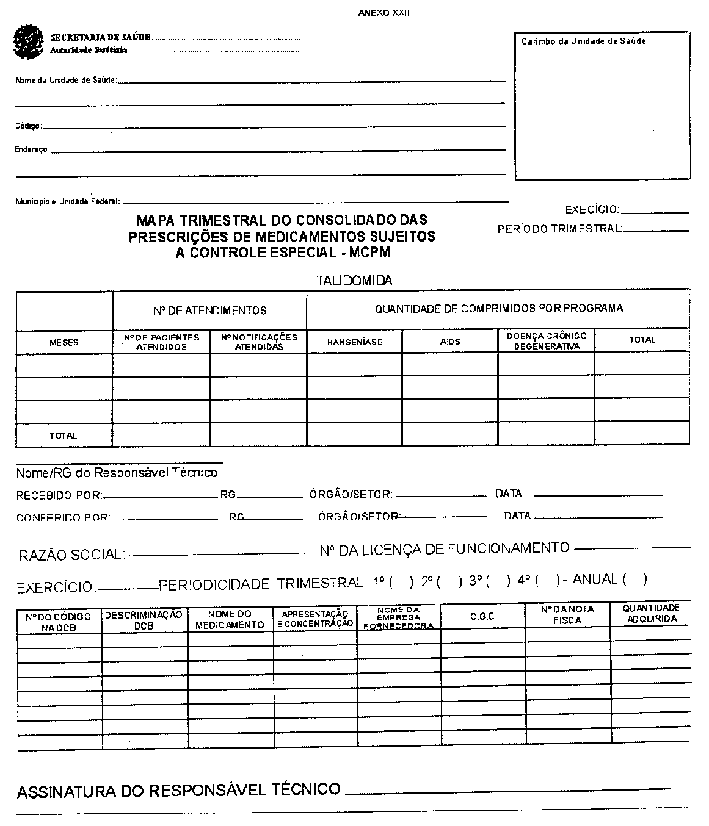
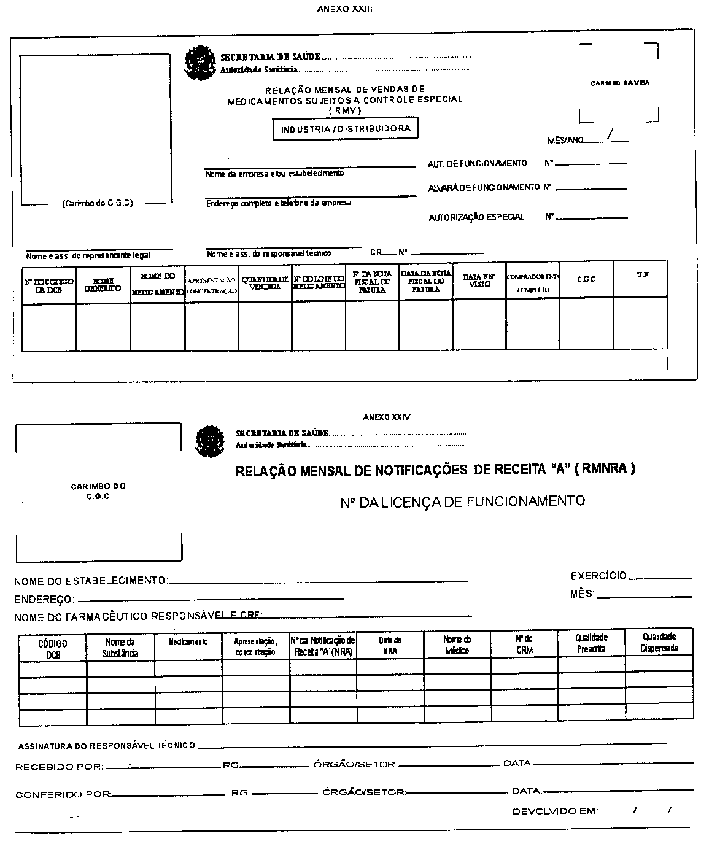

ASSUNTOS PREVIDENCIÁRIOS |
RESÍDUO DE
PARCELAMENTO - DÉBITOS DE DIMINUTO VALOR
DISPENSA DA COBRANÇA
RESUMO: A Resolução a seguir dispõe sobre a dispensa da cobrança de débitos de diminuto valor (até R$ 35,00), decorrentes de resíduo de parcelamento.
RESOLUÇÃO INSS Nº 537, de
11.05.98
(DOU de 13.05.98)
Dispõe sobre a aplicabilidade do artigo 54 da Lei nº 8.212, de 24 de julho de 1991 - Regulamento da Organização e do Custeio da Seguridade Social - ROCSS, aprovado pelo Decreto nº 2.173, de 05 de março de 1997.
O PRESIDENTE DO INSTITUTO NACIONAL DO SEGURO SOCIAL - INSS, no uso da atribuição que lhe confere o inciso V, artigo 133 do Regimento Interno, aprovado pela Portaria MPS nº 458, de 24 de setembro de 1992,
CONSIDERANDO o disposto nos artigos 33 e 54 da Lei nº 8.212, de 24 de julho de 1991 e o artigo 94 do ROCSS, aprovado pelo Decreto nº 2.173, de 05 de março de 1997, que autorizam ao INSS o estabelecimento de critérios para dispensa da exigência de crédito de valor que não justifique o custo dessa medida,
RESOLVE:
Determinar a baixa no Sistema Informatizado de Débitos, do resíduo de parcelamento oriundo de créditos de contribuições arrecadadas pelo INSS, cujo valor atualizado seja de até R$ 35,00 (trinta e cinco reais), além do arquivamento do respectivo processo.
Parágrafo único - Será efetuada a baixa de débito no sistema cujo valor atualizado seja de até R$ 35,00 (trinta e cinco reais), residual ou não, que esteja em manutenção, bem como o arquivamento do respectivo processo, desde que não conste outro débito do mesmo devedor.
Esta Resolução entra em vigor na data de sua publicação e revoga a Resolução/INSS/PR/Nº 469, de 15 de julho de 1997.
Crésio de Matos Rolim
SALÁRIO DE
CONTRIBUIÇÃO, SALÁRIO-BASE, QUOTA DE SALÁRIO-FAMÍLIA E OUTROS VALORES
MAIO/98
RESUMO: A Ordem de Serviço a seguir divulga o salário de contribuição, salário-base, quota de salário-família e outros valores, vigentes para o mês de maio de 1998.
ORDEM DE SERVIÇO INSS/DAF Nº
186, de 12.05.98
(DOU de 18.05.98)
Salário de contribuição, salário-base, quota de salário-família e outros valores, vigentes para o mês de maio de 1998.
FUNDAMENTAÇÃO:
Lei nº 8.212, de 24.07.91 e alterações;
Lei nº 8.213, de 24.07.91 e alterações;
Lei nº 9.311, de 24.10.96;
Medida Provisória nº 1.656, de 29.04.98;
Portaria MPAS nº 4.448, de 07.05.98.
O DIRETOR DE ARRECADAÇÃO E FISCALIZAÇÃO, no uso das atribuições que lhe confere o artigo 175, inciso III do Regimento Interno do Instituto Nacional do Seguro Social - INSS, aprovado pela Portaria MPS nº 458, de 24 de setembro de 1992,
RESOLVE:
1 - Divulgar os valores para os salários de contribuição do segurado empregado e dos segurados autônomo e equiparado, empresário e facultativo contribuintes por escala de salário-base, da quota de salário família, da multa variável na ocorrência de infração a qualquer dispositivo do ROCSS e da exigência de CND para alienação ou oneração de bem móvel incorporado ao ativo permanente da empresa (anexo I), vigentes para o mês de maio de 1998.
2 - Esta Ordem de Serviço entra em vigor na data de sua publicação, revogadas as disposições em contrário.
Luiz Alberto Lazinho
ANEXO I
Tabela de contribuição dos segurados empregados, empregado doméstico e trabalhador
avulso, vigente para o mês de maio de 1998.
| Salário de contribuição (R$) | Alíquota (%) |
| até 309,56 | 7,82% |
| de 309,57 até 390,00 | 8,82% |
| de 390,01 até 515,93 | 9,00% |
| de 515,94 até 1.031,87 | 11,00% |
OBS: A alíquota é reduzida apenas para remunerações até R$ 390,00 em função do disposto no inciso II do art. 17 da Lei nº 9.311, de 24 de outubro de 1996.
Escala de salários-base para os segurados autônomo e equiparado, empresário e facultativo, vigente para o mês de maio de 1998.
| Classe | Interstício (meses) | Salário-base (R$) | Alíquota (%) | Contribuição (R$) |
| 1 | 12 | 130,00 | 20 | 26,00 |
| 2 | 12 | 206,37 | 20 | 41,27 |
| 3 | 24 | 309,56 | 20 | 61,91 |
| 4 | 24 | 412,74 | 20 | 82,55 |
| 5 | 36 | 515,93 | 20 | 103,19 |
| 6 | 48 | 619,12 | 20 | 123,82 |
| 7 | 48 | 722,30 | 20 | 144,46 |
| 8 | 60 | 825,50 | 20 | 165,10 |
| 9 | 60 | 928,68 | 20 | 185,74 |
| 10 | - | 1.031,87 | 20 | 206,37 |
Quota de salário-família
| Remuneração | Valor unitário da quota |
| Até R$ 309,56 | R$ 8,25 |
| Acima de R$ 309,56 | R$ 1,02 |
Contribuição do empregador doméstico: 12% da remuneração
Contribuição do empregado doméstico: 7,82%, 8,82%, 9,00% ou 11,00%
Infração a qualquer dispositivo do ROCSS - Decreto nº 2.173/97 - artigo 106,, multa variável de R$ 606,98 a R$ 60.697,79
Exigência CND - Decreto nº 2.173/97 - artigo 84 - para alienação / oneração de bem móvel incorporado ao ativo permanente da empresa de valor superior a R$ 15.174,30
Associação desportiva que mantém equipe de futebol profissional - 5% da receita bruta,, sem dedução e contribuições descontadas dos empregados,, atletas ou não,, e as relativas a terceiros.
ASSUNTOS TRABALHISTAS |
PARTICIPAÇÃO
DOS TRABALHADORES NOS LUCROS OU RESULTADOS DAS EMPRESAS
NORMAS
RESUMO: Deixamos de transcrever a íntegra da presente Medida Provisória, tendo em vista que o seu texto não apresenta substanciais modificações em relação à sua última reedição (MP nº 1.619-43/98, publicada no Bol. INFORMARE nº 19/98).
MEDIDA PROVISÓRIA Nº 1.619-44,
de 12.05.98
(DOU de 13.05.98)
Dispõe sobre a participação dos trabalhadores nos lucros ou resultados da empresa e dá outras providências.
TRABALHO
PORTUÁRIO
NORMAS E CONDIÇÕES GERAIS DE PROTEÇÃO
RESUMO: Deixamos de transcrever a íntegra da presente Medida Provisória, tendo em vista que o seu texto não apresenta substanciais modificações em relação ao da MP nº 1.575-5/97 (Bol. INFORMARE nº 46/97).
MEDIDA PROVISÓRIA Nº 1.630-12,
de 12.05.98
(DOU de 13.05.98)
Dispõe sobre normas e condições gerais de proteção ao trabalho portuário, institui multas pela inobservância de seus preceitos, e dá outras providências.
PIS/PASEP
ABONO SALARIAL REFERENTE AO EXERCÍCIO DE 1997/98 - PRORROGAÇÃO
RESUMO: Foi prorrogado até 15 de junho de 1998, o prazo para o pagamento do Abono Salarial, referente ao exercício de 1997/1998, estabelecido nos anexos I e II da Resolução nº 147, de 1º de setembro de 1997.
RESOLUÇÃO CODEFAT Nº 166, de
13.05.98
(DOU de 15.05.98)
Altera a Resolução nº 163, de 14 de abril de 1998, que prorroga o prazo para pagamento do Abono Salarial referente ao exercício de 1997/1998.
O CONSELHO DELIBERATIVO DO FUNDO DE AMPARO AO TRABALHADOR - CODEFAT, no uso das atribuições que lhe confere o inciso V do artigo 19 da Lei nº 7.998, de 11 de janeiro de 1990, resolve:
Art. 1º - Alterar a Resolução nº 163/98, que passa a vigorar com a seguinte redação:
"Art. 1º Prorrogar, até 15 de junho de 1998, o prazo para o pagamento do Abono Salarial, referente ao exercício de 1997/1998, estabelecido nos anexos I e II da Resolução nº 147, de 1º de setembro de 1997.
Art. 2º - Prorrogar, por 46 (quarenta e seis) dias, o prazo para divulgação do Relatório Gerencial do Fundo de Amparo ao Trabalhador - FAT, de que a trata a Resolução nº 74, de 16 de dezembro de 1994."
Art. 2º - Esta Resolução entra em vigor na data de sua publicação, revogadas as disposições em contrário.
Delúbio Soares de Castro
SEGURO-DESEMPREGO
DISPENSA DA APOSIÇÃO DO CARIMBO DO CGC NOS FORMULÁRIOS
RESUMO: A Resolução a seguir faculta às Pessoas Jurídicas de Direito Público ou Privado a substituírem o carimbo do CGC, pela transcrição do número da inscrição, do nome e endereço completo nos formulários de Requerimento do Seguro-Desemprego.
RESOLUÇÃO CODEFAT Nº 168, de
13.05.98
(DOU de 15.05.98)
Faculta às Pessoas Jurídicas de Direito Público ou Privado a substituírem o carimbo do CGC, pela transcrição do número da inscrição, do nome e endereço completo nos formulários de Requerimento do Seguro-Desemprego.
O CONSELHO DELIBERATIVO DO FUNDO DE AMPARO AO TRABALHADOR - CODEFAT, no uso das atribuições que lhe confere o inciso V, do artigo 19, da Lei nº 7.998, de 11 de janeiro de 1990, resolve:
Art. 1º - Facultar às Pessoas Jurídicas de Direito Público ou Privado a substituição do uso do carimbo do CGC (Cadastro Geral de Contribuintes) nos formulários de Requerimento do Seguro-Desemprego - SD e da Comunicação de Dispensa - CD, pela transcrição do número da inscrição, do nome e endereço completo, inclusive o CEP, do empregador.
Art. 2º - O empregador que optar pela dispensa do carimbo, nos termos do artigo 1º, deverá apor os dados no campo destinado ao CGC, na seguinte ordem: número da inscrição, o nome da empresa em letra maiúscula, endereço, CEP e a localidade.
Art. 3º - Esta Resolução entra em vigor na data de sua publicação, revogadas as disposições em contrário.
Delúbio Soares de Castro
SEGURANÇA E
SAÚDE NO TRABALHO
PRODUTORES DE ÁLCOOL ANIDRO - UTILIZAÇÃO DE BENZENO
RESUMO: A Portaria a seguir estabelece os prazos de 31 de dezembro de 1998, na região Centro - Sul e 31 de maio de 1999, na região Norte - Nordeste, para que os produtores de álcool anidro que utilizam o benzeno como desidratante na destilação azeotrópica promovam a sua substituição.
PORTARIA SSST Nº 27, de 08.05.98
(DOU de 14.05.98)
O SECRETÁRIO DE SEGURANÇA E SAÚDE NO TRABALHO, no uso das atribuições que lhe confere o artigo 10, inciso II, do Anexo I, do Decreto nº 1643, de 25 de setembro de 1995, publicado no DOU do dia 26/09/95, Seção I, páginas 14.941 a 14.945; e,
CONSIDERANDO o disposto no item 3, alínea "e", da Portaria SSST nº 14, de 20 de dezembro de 1995, publicada no DOU de 22 de dezembro de 1995, Seção I, páginas 21.864 a 21.866, resolve:
Art. 1º - Estabelecer os prazos de 31 de dezembro de 1998, na região Centro - Sul e 31 de maio de 1999, na região Norte - Nordeste, para que os produtores de álcool anidro que utilizam o benzeno como desidratante na destilação azeotrópica promovam a sua substituição.
Art. 2º - Eventuais pedidos de prorrogação de prazos para substituição determinada no artigo anterior, deverão ser encaminhadas à SSST/MTb para análise, até 30 de novembro de 1998, e quando deferido o pedido, a prorrogação não será concedida por prazo superior a 1(hum) ano.
Art. 3º - Esta Portaria entra em vigor na data de sua publicação.
Zuher Handar
PIS/PASEP
PAGAMENTO DOS RENDIMENTOS - EXERCÍCIO 1997/98 - PRORROGAÇÃO
RESUMO: Foi prorrogado até 15.06.98 o pagamento dos rendimentos (juros e resultado líquido adicional) do PIS/Pasep referente ao exercício 1997/98.
RESOLUÇÃO CDFP/PIS/PASEP Nº 2,
de 14.05.98
(DOU de 15.05.98)
O CONSELHO DIRETOR DO FUNDO DE PARTICIPAÇÃO PIS-PASEP, no uso das atribuições que lhe confere o artigo 10 do Decreto nº 78.276, de 17 de agosto de 1976, e considerando que:
a) nos termos do § 3º do art. 239 da Constituição da República, os rendimentos das contas individuais integram o Abono assegurado aos empregados que percebem até dois salários mínimos de remuneração mensal; e
b) o pagamento do Abono, que é da competência do Conselho Deliberativo do Fundo de Amparo ao Trabalhador - CODEFAT, foi prorrogado até 15 de junho de 1998,
RESOLVE:
I - Autorizar a prorrogação, até 15 de junho de 1998, do prazo para pagamento dos rendimentos (juros e Resultado Líquido Adicional) previsto no § 2º do artigo 4º da Lei Complementar nº 26, de 11 de setembro de 1975; e
II - Esta Resolução entra em vigor na data de sua publicação.
Almério Cançado de Amorim
Coordenador do Conselho
ICMS |
ISENÇÃO NA
IMPORTAÇÃO DE EQUIPAMENTO MÉDICO-HOSPITALAR
RJ, AM, PA, RN, AC E PE - RETIFICAÇÃO
RESUMO: O Convênio ICMS-05/98 (Suplemento Especial anexo ao Bol. INFORMARE nº 16/98) foi objeto de retificação, conforme o DOU de 15.05.98.
CONVÊNIO ICMS 05/98, de 20.03.98
(DOU de 15.05.98)
No Convênio ICMS 05/98, de 20 de março de 1998, publicado no DOU de 26.03.98, seção I, página 6/11, no Parágrafo único,
onde se lê: "Parágrafo único - A comprovação da ausência de similaridade deverá ser feita por laudo emitido por órgão federal.",
leia-se: "Parágrafo único - A comprovação da ausência de similaridade deverá ser feita por laudo emitido por entidade representativa do setor, de abrangência nacional, ou órgão federal competente".
SUBSTITUIÇÃO
TRIBUTÁRIA NAS OPERAÇÕES COM DISCO FONOGRÁFICO, FITA VIRGEM OU GRAVADA
ADESÃO DO ESTADO DO ACRE - RETIFICAÇÃO
RESUMO: Foi procedida retificação no Protocolo ICMS nº 11/98 (Suplemento especial anexo ao Bol. INFORMARE nº 06/98), que dispõe sobre a adesão do Acre ao Protocolo ICM nº 19/85.
PROTOCOLO ICMS Nº 11/98, de
20.03.98
(DOU de 12.05.98)
No Protocolo ICMS 11/98, de 20 de março de 1998, publicado no DOU, de 26.03.98, seção I, página 35/36, Cláusula segunda
Onde se lê:
"Cláusula segunda - Este protocolo entra em vigor na data de sua publicação, produzindo efeitos a partir de 1º de janeiro de 1998."
Leia-se:
"Cláusula segunda - Este protocolo entra em vigor na data de sua publicação, produzindo efeitos a partir de 1º de abril de 1998.".
IMPOSTO DE RENDA |
RENDIMENTOS DE APLICAÇÕES FINANCEIRAS
INCIDÊNCIA DO IRRFRESUMO: Deixamos de transcrever a íntegra da presente Medida Provisória, tendo em vista que o seu texto não apresenta substanciais modificações em relação ao da MP nº 1.636/97 (Bol. INFORMARE nº 01/98).
MEDIDA PROVISÓRIA Nº 1.636-5, de 12.05.98
(DOU de 13.05.98)Dispõe acerca da incidência do imposto de renda na fonte sobre rendimentos de aplicações financeiras e dá outras providências.
PESSOA JURÍDICA
MUDANÇA DE OPÇÃO DO LUCRO PRESUMIDO PARA O LUCRO REAL - RECOLHIMENTO DOS ACRÉSCIMOS LEGAISRESUMO: O Ato Declaratório a seguir dispõe sobre o recolhimento dos acréscimos legais decorrentes da mudança de opção do lucro presumido para o lucro real.
ATO DECLARATÓRIO COSAR Nº 34, de 13.05.98
(DOU de 15.05.98)Recolhimento de acréscimos legais decorrentes da mudança de opção do lucro presumido para o lucro real.
O COORDENADOR-GERAL DO SISTEMA DE ARRECADAÇÃO E COBRANÇA, no uso de suas atribuições, e tendo em vista o disposto no Ato Declaratório (Normativo) nº 3, de 9 de abril de 1998,
DECLARA:
1. O recolhimento de valores relativos exclusivamente à multa moratória, aos juros de mora, ou a ambos, referentes ao Imposto de Renda das Pessoas Jurídicas - IRPJ e à Contribuição Social sobre o Lucro Líquido - CSLL, apurados de conformidade com as alíneas "f" e "g" do Ato Declaratório Normativo nº 3, de 09 de abril de 1998, será efetuado, na data em que se realizar a compensação, por intermédio de Documento de Arrecadação de Receitas Federais - DARF, preenchido de acordo com as instruções abaixo:
CAMPO DO DARF O QUE DEVE CONTER 01 Informar o nome do contribuinte e respectivo telefone 02 Informar o período de apuração do imposto/contribuição a que se refere o recolhimento 03 Indicar o número do CGC do contribuinte 04 Preencher com o código do imposto ou contribuição correspondente à nova sistemática de apuração 05 Não preencher 06 Indicar o vencimento correspondente ao período de apuração informado no campo 02 07 Não preencher 08 Informar o valor da multa,, se for o caso 09 Informar o valor dos juros de mora,, se for o caso 10 Indicar a soma dos valores constantes dos campos 08 e 09 2. Este ato entra em vigor na data de sua publicação.
Michiaki Hashimura
IMPORTAÇÃO/EXPORTAÇÃO |
IMPORTAÇÃO
SISCOMEX - SISTEMA DE LICENCIAMENTO - ALTERAÇÃO
RESUMO: Foi acrescentado o parágrafo único ao art. 14 da Portaria Secex nº 21/96, tratando da dispensa de descrição detalhada das peças sobressalentes que acompanham as máquinas e/ou equipamentos importados, desde que observadas as condições estabelecidas pelo referido dispositivo.
PORTARIA SECEX Nº 3, de 14.05.98
(DOU de 18.05.98)
O SECRETÁRIO DE COMÉRCIO EXTERIOR, DO MINISTÉRIO DA INDÚSTRIA, DO COMÉRCIO E DO TURISMO, no uso das atribuições que lhe conferem o Decreto nº 1.757, de 22 de dezembro de 1995, e a Portaria MICT nº 105, de 26 de abril de 1996, e tendo em vista o que dispõe o Decreto nº 660, de 25 de setembro de 1992, que instituiu o Sistema Integrado de Comércio Exterior - SISCOMEX, e a Portaria Interministerial MF/MICT nº 291, de 12 de dezembro de 1996,
RESOLVE:
Art. 1º - Fica acrescido um parágrafo único ao artigo 14 da Portaria Secex nº 21, de 12 de dezembro de 1996, com o seguinte teor:
"Parágrafo único - É dispensada a descrição detalhada das peças sobressalentes que acompanham as máquinas e/ou equipamentos importados, desde que observadas as seguintes condições:
I - as peças sobressalentes devem figurar na mesma licença de importação que cobre a trazida das máquinas e/ou equipamentos, inclusive com o mesmo código da Nomenclatura Comum do Mercosul - NCM, não podendo seu valor ultrapassar 10% (dez por cento) do valor da máquina e/ou do equipamento;
II - o valor das peças sobressalentes deve estar previsto na documentação relativa à importação (contrato, projeto, fatura, e outros)."
Art. 2º - Esta Portaria entra em vigor na data de sua publicação.
Maurício E. Cortes Costa
IMPORTAÇÃO
PROCESSAMENTO DO DESEMBARAÇO COM BASE EM DECLARAÇÃO SIMPLIFICADA - AUSÊNCIA DE LI -
ESCLARECIMENTO
RESUMO: O Ato Declaratório a seguir esclarece sobre a não aplicação da penalidade prevista no Regulamento Aduaneiro no caso de ausência de LI nas condições do art. 55 da IN SRF nº 69/96 (processamento do desembaraço com base em Declaração Simplificada, nos casos de amostras, importações sem cobertura cambial etc.).
ATO DECLARATÓRIO COSAD Nº 39,
de 13.05.98
(DOU de 15.05.98)
O COORDENADOR-GERAL DO SISTEMA ADUANEIRO, no uso de suas atribuições,
DECLARA:
A ausência de LI, nas condições previstas no art. 55 da IN SRF nº 69, de 10 de dezembro de 1996, não constitui infração, para efeito de aplicação da multa prevista no art. 526, incisos II e VI, do Regulamento Aduaneiro, aprovado pelo Decreto nº 91.030, de 05 de março de 1985.
Este Ato Declaratório entra em vigor na data de sua publicação.
Álvaro Nunes de Oliveira
IMPORTAÇÃO/EXPORTAÇÃO
REMESSAS EXPRESSAS - APLICAÇÃO DE PENA DE SUSPENSÃO À EMPRESA DE COURIER
RESUMO: O Ato Declaratório a seguir dispõe sobre a aplicação da pena de suspensão à empresa de courier, de que trata a IN SRF nº 57/96, que disciplina o despacho de remessas expressas.
ATO DECLARATÓRIO COSAD Nº 40,
de 13.05.98
(DOU de 15.05.98)
O COORDENADOR-GERAL DO SISTEMA ADUANEIRO, no uso da delegação de competência contida no art. 60 da Instrução Normativa SRF nº 57, de 01.10.96,
DECLARA:
A aplicação da pena de suspensão, prevista no inciso II do art. 53 da IN SRF nº 57/96, cabe ao Superintendente da Receita Federal responsável pela habilitação da empresa de courier.
Este Ato Declaratório entra em vigor na data de sua publicação.
Álvaro Nunes de Oliveira
ZONA FRANCA DE
MANAUS
LIMITES ADICIONAIS DE IMPORTAÇÃO - DISTRIBUIÇÃO
RESUMO: A Portaria a seguir dispõe sobre a distribuição dos limites adicionais de importação.
PORTARIA SUFRAMA Nº 105, de
12.05.98
(DOU de 15.05.98)
O SUPERINTENDENTE DA ZONA FRANCA DE MANAUS, no uso das atribuições que lhe confere o artigo 4º do Regimento Interno da Autarquia,
RESOLVE:
Art. 1º - Para efeito de distribuição dos limites adicionais de importação, de que trata o art. 4º do Decreto nº 2.569, de 29 de abril de 1998, as empresas comerciais em operação deverão apresentar até o dia 25 de cada mês, formulário com as informações necessárias, conforme modelo em anexo.
Art. 2º - Somente poderão se habilitar à obtenção de limite adicional de importação, as empresas comerciais em operação que, do total da quota inicial atribuída, acrescida dos adicionais eventualmente concedidos, tenham efetivado importações equivalentes a, no mínimo 1/12 cumulativos, referentes aos meses compreendidos entre maio de 1998 até o anterior à distribuição.
Art. 3º - Esta Portaria entra em vigor na data de sua publicação.
Mauro Ricardo Machado Costa
ANEXO
REQUERIMENTO DE LIMITE ADICIONAL DE IMPORTAÇÃO
Requeremos o estabelecimento de limite adicional de importação, nos termos da Portaria nº 0105, de 12 de maio de 1998, e para tanto prestamos as informações abaixo relacionadas:
| 1. INSCRIÇÃO SUFRAMA | ||
| 2. RAZÃO SOCIAL | ||
| 3. ENDEREÇO | TEL.: | |
| 4. RECOLHIMENTO DE TRIBUTOS NO ANO DE 1997 (R$) | ||||
| COFINS | PIS | ICMS | IR | CSL |
| 5. NÚMERO DE EMPREGADOS DA EMPRESA, NA ZFM OU ALC, EM 31.12.97 |
| 6. BENS IMÓVEIS DA EMPRESA NA AMAZÔNIA OCIDENTAL E/OU ALC DE MACAPÁ/SANTANA | |||
| Nº ORDEM | TIPO | MATRÍCULA DO IPTU | BASE DE CÁLCULO DO IPTU (R$) |
| TOTAL | |||
OBS.: A EMPRESA DEVERÁ ANEXAR REGISTROS DOS IMÓVEIS DECLARADOS E AS RESPECTIVAS GUIAS DE IPTU
| 7. IDENTIFICAÇÃO DO REPRESENTANTE-LEGAL DA EMPRESA | |
| NOME: ________________________________ | CPF:_______________________ |
| 8. TERMO DE RESPONSABILIDADE | |
| AS INFORMAÇÕES ACIMA SÃO A EXPRESSÃO DA VERDADE | |
| LOCAL E DATA | Assinatura do representante legal da empresa |
IPI |
CLASSIFICAÇÃO PARA EFEITO DE CÁLCULO E PAGAMENTO DO IMPOSTO
RESUMO: O Ato Declaratório a seguir dá nova classificação às bebidas que indica, para efeito de cálculo e pagamento do IPI.
ATO DECLARATÓRIO SRF Nº 45, de
11.05.98
(DOU de 13.05.98)
O SECRETÁRIO DA RECEITA FEDERAL, no uso da delegação de competência conferida pela Portaria MF nº 678, de 22 de outubro de 1992,
DECLARA que os produtos relacionados neste Ato Declaratório, para efeito de cálculo e pagamento do Imposto sobre Produtos Industrializados - IPI, de que tratam os arts. 1º da Lei nº 7.798, de 10 de julho de 1989, e 2º da Lei nº 8.133, de 27 de dezembro de 1990, passam a ser classificados, conforme o enquadramento ora estabelecido, observado, no que for aplicável, o disposto na Portaria MF nº 139, de 19 de junho de 1989.
| CGC | MARCA COMERCIAL | CÓDIGO TIPI.NCM | CAPACIDADE | LETRA |
| 01.731.172/0001-06 | Capricho | 2205.10.00 | 600 ml | B |
| 01.731.172/0001-06 | Capricho | 2208.90.00 ex 10 | 600 ml | D |
| 01.731.172/0001-06 | Capricho | 2205.10.00 | 900 ml | E |
| 79.387.379/0001-94 | Burigo | 2205.10.00 | 900 ml | |
| 01.172.180/0001-51 | São Braz | 2208.90.00 ex 3 | 900 ml | G |
| 01.731.172/0001-06 | Capricho | 2208.90.00 ex 10 | 800 ml | |
| 79.387.379/0001-94 | Burigo | 2208.90.00 ex 4 | 900 ml | |
| 79.387.379/0001-94 | Burigo | 2208.90.00 ex 10 | 900 ml | |
| 01.731.172/0001-06 | Aklov | 2208.60.00 | 600 ml | I |
| 79.387.379/0001-94 | Burigo | 2208.90.00 ex 11 | 900 ml | |
| 01.731.172/0001-06 | Aklov | 2208.60.00 | 900 ml | L |
| 79.387.379/0001-94 | Stalak | 2208.60.00 | 900 ml |
Everaldo Maciel
PIS |
PIS
DETERMINAÇÃO DA BASE DE CÁLCULO
RESUMO: Estamos publicando a íntegra da presente MP, tendo em vista que o seu texto apresenta modificações, especialmente o acréscimo do art. 5º tratando da contribuição sindical rural.
MEDIDA PROVISÓRIA Nº 1.617-51,
de 12.05.98
(DOU de 13.05.98)
Dispõe sobre a base de cálculo da contribuição para o Programa de Integração Social - PIS devida pelas pessoas jurídicas a que se refere o § 1º do art. 22 da Lei nº 8.212, de 24 de julho de 1991, e dá outras providências.
O PRESIDENTE DA REPÚBLICA, no uso da atribuição que lhe confere o art. 62 da Constituição, adota a seguinte Medida Provisória, com força de lei:
Art. 1º - Para efeito de determinação da base de cálculo da contribuição para o Programa de Integração Social - PIS, de que trata o inciso V do art. 72 do Ato das Disposições Constitucionais Transitórias, as pessoas jurídicas referidas no § 1º do art. 22 da Lei nº 8.212, de 24 de julho de 1991, poderão efetuar as seguintes exclusões ou deduções da receita bruta operacional auferida no mês:
I - reversões de provisões operacionais e recuperações de créditos baixados como prejuízo, que não representem ingresso de novas receitas, o resultado positivo da avaliação de investimentos pelo valor do patrimônio líquido e os lucros e dividendos derivados de investimentos avaliados pelo custo de aquisição, que tenham sido computados como receita;
II - valores correspondentes a diferenças positivas decorrentes de variações nos ativos objetos dos contratos, no caso de operações de "swap" ainda não liquidadas;
III - no caso de bancos comerciais, bancos de investimentos, bancos de desenvolvimento, caixas econômicas, sociedades de crédito, financiamento e investimento, sociedades de crédito imobiliário, sociedades corretoras, distribuidoras de títulos e valores mobiliários, empresas de arrendamento mercantil e cooperativas de crédito:
a) despesas de captação em operações realizadas no mercado interfinanceiro, inclusive com títulos públicos;
b) encargos com obrigações por refinanciamentos, empréstimos e repasses de recursos de órgãos e instituições oficiais;
c) despesas de câmbio;
d) despesas de arrendamento mercantil, restritas a empresas e instituições arrendadoras;
e) despesas de operações especiais por conta e ordem do Tesouro Nacional;
IV - no caso de empresas de seguros privados:
a) cosseguro e resseguro cedidos;
b) valores referentes a cancelamentos e restituições de prêmios que houverem sido computados como receitas;
c) a parcela dos prêmios destinada à constituição de provisões ou reservas técnicas;
V - no caso de entidades de previdência privada abertas e fechadas, a parcela das contribuições destinada à constituição de provisões ou reservas técnicas;
VI - no caso de empresas de capitalização, a parcela dos prêmios destinada à constituição de provisões ou reservas técnicas.
§ 1º - É vedada a dedução de prejuízos, de despesas incorridas na cessão de créditos e de qualquer despesa administrativa.
§ 2º - Nas operações realizadas em mercados futuros, sujeitos a ajustes diários, a base de cálculo da contribuição para o PIS é o resultado positivo dos ajustes ocorridos no mês.
§ 3º - As exclusões e deduções previstas neste artigo restringem-se a operações autorizadas às empresas ou entidades nele referidas, desde que realizadas dentro dos limites operacionais previstos na legislação pertinente.
Art. 2º - A contribuição de que trata esta Medida Provisória será calculada mediante a aplicação da alíquota de 0,75% sobre a base de cálculo apurada nos termos deste ato.
Art. 3º - As contribuições devidas pelas empresas públicas e sociedades de economia mista referidas no § 1º do art. 22 da Lei nº 8.212, de 1991, serão calculadas e pagas segundo o disposto nesta Medida Provisória.
Art. 4º - O pagamento da contribuição apurada de acordo com esta Medida Provisória deverá ser efetuado até o último dia útil da quinzena subseqüente ao mês de ocorrência dos fatos geradores.
Art. 5º - O art. 1º do Decreto-lei nº 1.166, de 15 de abril de 1971, passa a vigorar com a seguinte redação:
"Art. 1º - Para efeito da cobrança da contribuição sindical rural prevista nos arts. 149 da Constituição Federal e 578 a 591 da Consolidação das Leis do Trabalho, considera-se:
I - trabalhador rural:
a) a pessoa física que presta serviço a empregador rural mediante remuneração de qualquer espécie;
b) quem, proprietário ou não, trabalhe individualmente ou em regime de economia familiar, assim entendido o trabalho dos membros da mesma família, indipensável à própria subsistência e exercido em condições de mútua dependência e colaboração, ainda que com ajuda eventual de terceiros;
II - empresário ou empregador rural:
a) a pessoa física ou jurídica que, tendo empregado, empreende, a qualquer título, atividade econômica rural;
b) quem, proprietário ou não, e mesmo sem empregado, em regime de economia familiar, explore imóvel rural que lhe absorva toda a força de trabalho e lhe garanta a subsistência e progresso social e econômico em área superior a dois módulos rurais da respectiva região;
c) os proprietários de mais de um imóvel rural, desde que a soma de suas áreas seja superior a dois módulos rurais da respectiva região." (NR)
Art. 6º - Ficam convalidados os atos praticados com base na Medida Provisória nº 1.617-50, de 09 de abril de 1998.
Art. 7º - Esta Medida Provisória entra em vigor na data de sua publicação.
Art. 8º - Ficam revogados o art. 5º da Lei nº 7.691, de 15 de dezembro de 1988, e os arts. 1º, 2º e 3º da Lei nº 8.398, de 7 de janeiro de 1992.
Brasília, 12 de maio de 1998; 177º da Independência e 110º da República.
Fernando Henrique Cardoso
Pedro Malan
PIS/PASEP
APURAÇÃO DAS CONTRIBUIÇÕES
RESUMO: Deixamos de publicar a íntegra da presente Medida Provisória, tendo em vista que o seu texto não apresenta substanciais modificações em relação ao da MP nº 1.623-28/98 (Bol. INFORMARE nº 06/98).
MEDIDA PROVISÓRIA Nº 1.623-32,
de 12.05.98
(DOU de 13.05.98)
Dispõe sobre as contribuições para os Programas de Integração Social e de Formação do Patrimônio do Servidor Público - PIS/PASEP, e dá outras providências.
TRIBUTOS FEDERAIS |
RESUMO: Deixamos de publicar a íntegra da presente Medida Provisória, tendo em vista que o seu texto não apresenta modificações em relação ao da MP nº 1.621-34/98 (Bol. INFORMARE nº 19/98).
MEDIDA PROVISÓRIA Nº 1.621-35,
de 12.05.98
(DOU de 13.05.98)
Dispõe sobre o Cadastro Informativo dos créditos não quitados de órgãos e entidades federais, e dá outras providências.
RESUMO: O Comunicado a seguir transcrito fixou a TR e a TBF relativas ao dia 07.05.98 em 0,5984% e 1,7452%, respectivamente.
COMUNICADO BACEN Nº 6.159, de
08.05.98
(DOU de 12.05.98)
Divulga a Taxa Referencial-TR e a Taxa Básica Financeira-TBF relativas ao dia 07 de maio de 1998.
De acordo com o que determina a Resolução nº 2.437, de 30.10.97, comunicamos que a Taxa Referencial-TR e a Taxa Básica Financeira-TBF relativas ao dia 07 de maio de 1998 são, respectivamente: 0,5984% (cinco mil, novecentos e oitenta e quatro décimos de milésimo por cento) e 1,7452% (um inteiro e sete mil, quatrocentos e cinqüenta e dois décimos de milésimo por cento).
Altamir Lopes
Chefe
RESUMO: O Comunicado a seguir transcrito fixou a TR e a TBF relativas ao dia 08.05.98 em 0,5387% e 1,6848%, respectivamente.
COMUNICADO BACEN Nº 6.160, de
11.05.98
(DOU de 13.05.98)
Divulga a Taxa Referencial-TR e a Taxa Básica Financeira-TBF relativas ao dia 08 de maio de 1998.
De acordo com o que determina a Resolução nº 2.437, de 30.10.97, comunicamos que a Taxa Referencial-TR e a Taxa Básica Financeira-TBF relativas ao dia 08 de maio de 1998 são, respectivamente: 0,5387% (cinco mil, trezentos e oitenta e sete décimos de milésimo por cento) e 1,6848% (um inteiro e seis mil, oitocentos e quarenta e oito décimos de milésimo por cento).
Altamir Lopes
Chefe
TR E TBF
DIAS 9, 10 E 11.05.98
RESUMO: O Comunicado a seguir transcrito fixou a TR e a TBF relativas aos dias:
09.05.98 em 0,5340% e 1,6801%;
10.05.98 em 0,6138% e 1,7608%; em 0,6886% e 1,8365%; respectivamente.
COMUNICADO BACEN Nº 6.164, de
12.05.98
(DOU de 14.05.98)
Divulga as Taxas Referenciais-TR e as Taxas Básicas Financeiras-TBF relativas aos dias 09, 10 e 11 de maio de 1998.
De acordo com o que determina a Resolução nº 2.437, de 30.10.97, divulgamos as Taxas Referenciais-TR e as Taxas Básicas Financeiras-TBF relativas aos períodos abaixo especificados:
I - Taxas Referenciais-TR:
a) de 09.05.98 a 09.06.98: 0,5340% (cinco mil, trezentos e quarenta décimos de milésimo por cento);
b) de 10.05.98 a 10.06.98: 0,6138% (seis mil, cento e trinta e oito décimos de milésimo por cento);
c) de 11.05.98 a 11.06.98: 0,6886% (seis mil, oitocentos e oitenta e seis décimos de milésimo por cento);
II - Taxas Básicas Financeiras-TBF:
a) de 09.05.98 a 09.06.98: 1,6801% (um inteiro e seis mil, oitocentos e um décimos de milésimo por cento);
b) de 10.05.98 a 10.06.98: 1,7608% (um inteiro e sete mil, seiscentos e oito décimos de milésimo por cento);
c) de 11.05.98 a 11.06.98: 1,8365% (um inteiro e oito mil, trezentos e sessenta e cinco décimos de milésimo por cento).
Altamir Lopes
Chefe
RESUMO: O Comunicado a seguir transcrito fixou a TR e a TBF relativas ao dia 12.05.98 em 0,6096% e 1,7566%, respectivamente.
COMUNICADO BACEN Nº 6.167, de
13.05.98
(DOU de 15.05.98)
Divulga a Taxa Referencial-TR e a Taxa Básica Financeira-TBF relativas ao dia 12 de maio de 1998.
De acordo com o que determina a Resolução nº 2.437, de 30.10.97, comunicamos que a Taxa Referencial-TR e a Taxa Básica Financeira-TBF relativas ao dia 12 de maio de 1998 são, respectivamente: 0,6096% (seis mil e noventa e seis décimos de milésimo por cento) e 1,7566% (um inteiro e sete mil, quinhentos e sessenta e seis décimos de milésimo por cento).
Altamir Lopes
Chefe
RESUMO: O Comunicado a seguir transcrito fixou a TR e a TBF relativas ao dia 13.05.98 em 0,6234% e 1,7705%, respectivamente.
COMUNICADO BACEN Nº 6.168, de
14.05.98
(DOU de 18.05.98)
Divulga a Taxa Referencial-TR e a Taxa Básica Financeira-TBF relativas ao dia 13 de maio de 1998.
De acordo com o que determina a Resolução nº 2.437, de 30.10.97, comunicamos que a Taxa Referencial-TR e a Taxa Básica Financeira-TBF relativas ao dia 13 de maio de 1998 são, respectivamente: 0,6234% (seis mil, duzentos e trinta e quatro décimos de milésimo por cento) e 1,7705% (um inteiro e sete mil, setecentos e cinco décimos de milésimo por cento).
Altamir Lopes
Chefe